Activer le mode zen
Ressource au format PDF
Classification
Des gouttes qui sèchent ou qui gèlent - De la couronne à l'accolade
02/05/2022
Travail réalisé dans le cadre des XXIXeOlympiades de Physique sous la tutelle de Olivier Buridant, professeur de Physique-Chimie et de Didier Soret, professeur de Mathématiques.
Résumé
Ce travail est le prolongement d’une activité expérimentale faite à la maison lors du second confinement. On nous demandait de réaliser des mesures d’angles de mouillage sur différents supports donnés, puis sur des objets du quotidien. Après avoir illustré les situations classiques de mouillage, de très hydrophiles aux superhydrophobes, nous avons remarqué, parfois, quelques comportements particuliers que nous avons décidé d’étudier : les couronnes et les accolades.
Les couronnes apparaissent lors du séchage de solutions salines sur différents supports cristallins ou non, hydrophiles ou hydrophobes. La structure en moule de savarin s’explique par l’évolution de l’angle de mouillage lors du séchage. La structure en accolade (qui ressemble fortement à la couronne d’Henri IV), quant à elle, apparaît lors de la cristallisation d’une goutte sur une surface très froide. L’angle initial de mouillage conditionne la forme finale. Nous étudierons également les cinétiques de ces deux phénomènes qui peuvent jouer un rôle important : le premier dans les sciences forensiques ou la paléoarchéologie, le second dans la forme de cristallisation de semiconducteurs ou le séchage d’encre 3D.
Table des matières
Introduction
Lundi 16 novembre 2020, nous entamons notre troisième semaine de confinement en demi-jauge : les semaines en présentiel alternent avec celles à la maison. Cette semaine nous serons en « distanciel », nous redécouvrons alors pour la seconde fois les cours en visioconférence et ceux déposés sur Pronote ou l’ENT. Malgré la distance et la situation particulière liée à la Covid-19, nos professeurs continuent à nous enseigner et à nous soutenir.
Notre journée se termine par Sciences de Laboratoire, une option de seconde qui permet de découvrir la démarche scientifique, essentiellement au travers de travaux pratiques. Nous travaillons sur le thème de l’eau, ce qui nous semble très intéressant, mais sans burette ni verrerie à la maison… il est bien compliqué d'être aussi rigoureux, on regrette de ne pas mettre notre blouse (de ne pas être au lycée). Mais grâce à l’imagination débordante de notre professeur, nous avons la chance de réaliser un TP à la maison avec nos propres moyens.
Il nous propose de nous intéresser à l’interaction entre l’eau et différentes surfaces. Pour cela, nous déposons de l’eau à l’aide d’une pipette fabriquée à partir d’une mine vide de stylo, d’un capuchon de stylo, d’une allumette, d’un pic … Bref, nous devons nous adapter. Pour l’eau, c’est identique : faute d’eau distillée, on peut faire fondre le givre du freezer ou prendre de l’eau faiblement minéralisée (Mont Roucous, Volvic), de l’eau de pluie… ou dans le pire des cas, on travaille avec de l’eau du robinet. Nous prenons alors plaisir à nous organiser un plan de travail dans notre cuisine ou notre bureau.
Le travail demandé est assez simple sur le papier : prendre des photos de profil d’une goutte sur une surface lisse horizontale à l’aide d’un téléphone ou d’une webcam puis mesurer l’angle de contact à l’aide d’un rapporteur sur un écran ou d’un des nombreux logiciels ou applications proposés. Nous essayons sur différentes surfaces en verre, en plastique d’abord propres et sèches, puis graissées et paraffinées. Nous découvrons que cet angle varie beaucoup et que l’eau ne s’étale pas toujours, elle ne mouille pas toujours le support. Notre professeur nous demande de laisser libre cours à notre imagination et d’essayer sur un maximum de surfaces. Nous devrons faire un bilan de nos travaux la semaine d’après.
Parmi nos nombreux essais, deux attirent notre attention en raison de leur comportement particulier :
- La goutte d’eau sur le chocolat dont l’angle évolue en fonction du temps ;
- La goutte d'eau sur un glaçon « sans eau » réutilisable (qui permet de refroidir une boisson sans y ajouter l’eau de la fusion). Le résultat est assez déconcertant et particulier.
Ce sont alors ces deux axes que nous allons développer dans cet article, figure 2.
|
|
1. La mesure de l'angle de contact - Définition, protocole et outils
1.1 Le mouillage
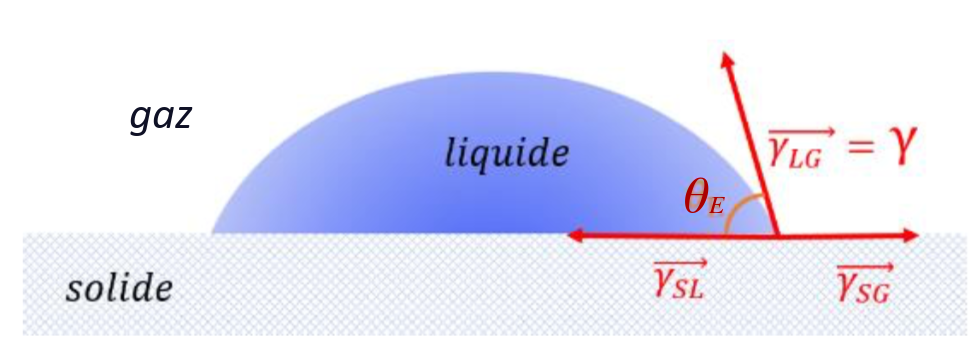
Le mouillage est l’étude de l’étalement d’un liquide déposé sur une surface, solide ou liquide. Cet étalement donne lieu à une ligne de contact entre trois phases : le liquide déposé, la surface, et l’air (ou le gaz dans lequel on est). Cette ligne est appelée ligne triple. L’angle \( \theta_E\), entre les interfaces liquide-air et liquide-solide au niveau de la ligne triple, est appelé angle de contact ou angle de Young. C’est l’angle à la base de la calotte sphérique, figure 3. Le comportement du mouillage dépend des interactions intermoléculaires, régies par les forces de tension superficielle entre les parties liquide, solide et gazeuse à l'interface de ces trois milieux.
|
Figure 3. Mesure de l'angle de contact |
Lorsque le liquide s'étale complètement, \(\theta_E = 0\) on parle de mouillage total. Si le liquide ne s'étale pas complètement mais forme une calotte sphérique, on est dans une situation de mouillage partiel. On distingue alors un liquide plutôt mouillant sur un substrat hydrophile pour \(\theta_E ≤ \frac{\pi}{2}\). Un liquide sera dit plutôt non-mouillant et le support hydrophobe si \(\theta_E ≥ \frac{\pi}{2}\). Finalement, si le liquide ne touche le solide qu'en un point, on parle de mouillage nul. Ces situations sont représentées sur la figure 4.
|
Figure 4. Mouillages partiels ou nul |
1.2 L'eau et le dépôt des gouttes
L’angle de contact dépend de la surface et de l’espèce chimique déposée. Notre bibliographie [ref1] nous a permis de voir que des espèces chimiques peuvent augmenter ou baisser la valeur de la tension superficielle de l’eau . Nous avons donc décidé de travailler avec de l’eau fraîchement distillée (préparée à l’aide du distillateur du laboratoire de chimie qui en produit près de 30 L par jour).
Nous l’avons ensuite distillée une seconde fois, avant de la mettre directement dans des petits pots de prélèvement neufs que nous avons étiquetés, figure 5. Le matériel de prélèvement est également à usage unique, on change de récipient et de matériel à chaque nouvelle expérience.
|
Figure 5. Préparation de l'eau bidistillée |
Lors de nos périodes confinées, nous avons utilisé ce qui était à notre disposition : des cartouches d’encre, des mines de stylo vides, des pics en bois plus ou moins long… À notre premier retour au lycée, notre professeur nous a distribué des minis kits contenant un tube à essais en plastique, un petit pot pour les échantillons, une pipette compte-gouttes jetable et sa version miniature. Cela nous a permis de progresser. Dans un premeir temps nous avons décidé de mesurer avec précision le volume déposé pour éventuellement vérifier son importance, comme cela avait été mentionné dans le projet « la caléfaction froide » [ref2]. Nous avons donc sollicité les biochimistes afin de demander l’emprunt d’une micropipette. Très généreusement, ils nous ont fourni plusieurs modèles avec des capacités différentes nous permettant de faire des dépôts de 1 μL à 200 μL. Nous avons décidé de changer les embouts à chaque dépôt.
|
Figure 6. Matériel de dépôt des gouttes |
Nous avons remarqué que la manière de réaliser les dépôts de gouttes influe beaucoup sur la valeur des angles de mouillage.
Dans un premier temps, nous avons construit un guide pour la pipette, constitué d'un tube vertical fixé à une potence. Ce tube est le corps d’un stylo publicitaire dont les dimensions internes correspondaient à celles de notre pipette. Simple et efficace au premier abord, ce système s'est avéré très fragile et problématique. En effet, la moindre maladresse lors du rangement ou un geste un peu brusque lors du retrait de la pipette suffisait à tout dérégler et nécessitait de ressortir le niveau laser. D’autre part, ce dispositif était aussi malcommode car si la pipette est parfaitement verticale et posée sur le support, le liquide ne peut pas sortir facilement, les surpressions sont synonymes de grosses bêtises.
Nous avons opté, dans un second temps, pour un système beaucoup plus simple. Une croix est réalisée sur une feuille A4, l’intersection des droites donne le lieu du dépôt sur la plaque de verre. Le support est placé dans l’axe d’une des droites, la seconde servant à ajuster la verticalité de la pipette dans le plan de « l’axe de la lame ». Au posé de la pipette on sent très bien avec de l’expérience la position verticale où l’embout pose à plat sur le bord du cône, on se décale alors très légèrement vers l’arrière en maintenant le contact avec la lame. On vide puis on retire d’un geste rapide la pipette. La concordance de nos résultats nous montre que la méthode est validée par l’expérience.
1.3 Protocole expérimental
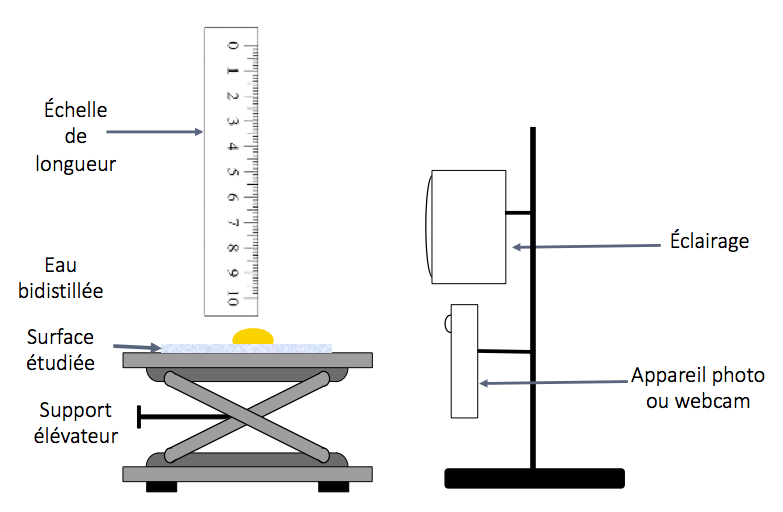
Nous avons utilisé, pour le début du projet, nos téléphones portables car les objectifs sont performants et nous sommes très habituées à les utiliser, puis une caméra USB du labo permettant d'avoir une meilleure résolution. Nous travaillons avec un système très stable en gérant au mieux l’éclairage et en ajoutant une échelle pour pouvoir étalonner nos photos, figure 7.
|
Figure 7. Schéma de l'installation |
En travaillant avec de l’eau seule, nous avions parfois beaucoup de mal à distinguer la base de goutte du support sur lequel elle était posée. Nous avons alors essayé de la colorer avec de l’encre ou des colorants alimentaires liquides. Le contraste était plus important, mais les résultats dépendaient des quantités ajoutées. Et ces produits du commerce contiennent parfois d’autres espèces chimiques. Pour contourner ces problèmes nous avons opté pour des colorants en poudre qui donnent des résultats plus reproductibles.
Nous avons choisi de nous intéresser à des espèces chimiques qui fluorescent, car pour être visible il suffit d'avoir des concentrations très faibles de l’ordre de 1.10-6 mol.L-1. La première espèce qui nous est venue à l’esprit est la fluorescéine mais pour émettre un maximum dans le vert (520 nm) elle doit être excitée à son maximum d’absorption soit à 490 nm (bleu) or nous ne disposons pas d’une telle source lumineuse. Nous nous sommes alors intéressées à :
- La quinine, présente dans les boissons comme le Schweppes ou dans des médicaments contre le paludisme disponibles en pharmacie, dans ce cas elle peut être considérée comme pure.
- L’esculine, présente dans les topinambours dont il est facile de l’extraire à l’aide de solvants.
Ces deux espèces fluorescent en bleu si elles sont soumises à des radiations ultra-violettes de 365 nm.
|
|
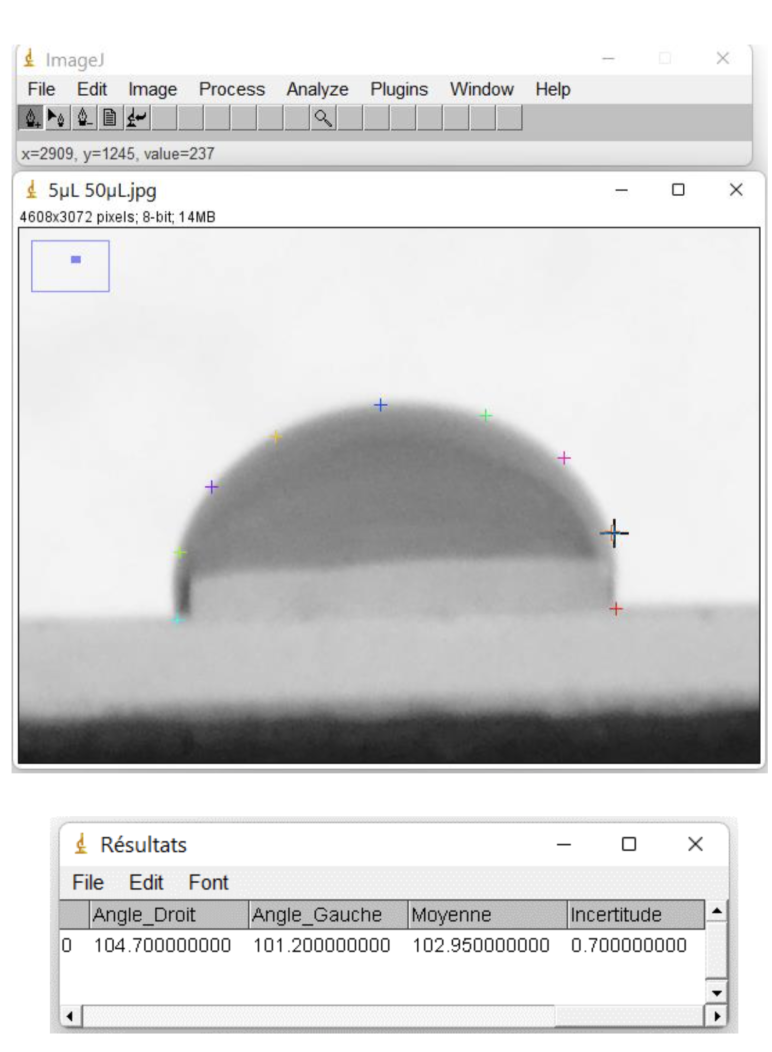
Pour mesurer les angles, nous avons utilisé le logiciel Image J [ref3]. Nous avons utilisé un module d'extension « Contact Angle » [ref4] en modifiant quelques lignes de code afin d'arriver à la valeur de l'angle recherché, figure 9.
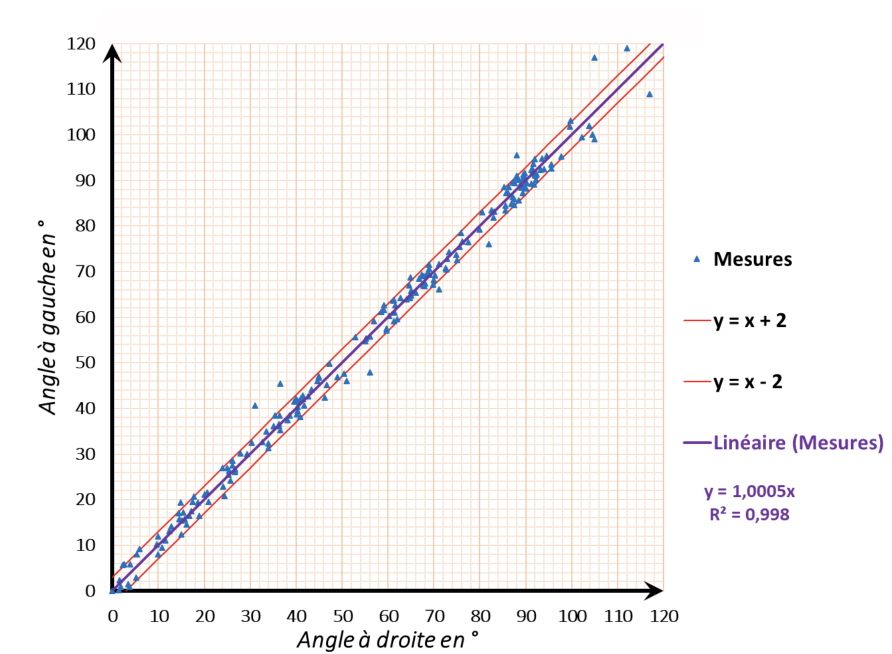
L'analyse sous Image J renvoie deux angles, l'un à gauche et l'autre à droite. Nous avons décidé de les comparer. Nous représentons sur la figure 10 la concordance des angles à gauche et à droite pour chaque mesure.
Même si nous observons une dispersion des résultats, nous obtenons une excellente corrélation entre les mesures de droite et de gauche : 91,5% des valeurs sont comprises dans une zone à plus ou moins 2 degrés de la première bissectrice.
1.4 Le volume de dépôt a-t-il une influence sur l'angle ?
Pour répondre à cette question, nous avons choisi de mesurer les angles de contact d'une goutte d'un volume de 2μL à 1 000 μL déposée sur une plaque de verre traitée à la paraffine alimentaire (sur une plaque de microscope ordinaire, l'eau s'étale trop pour des volumes aussi importants).
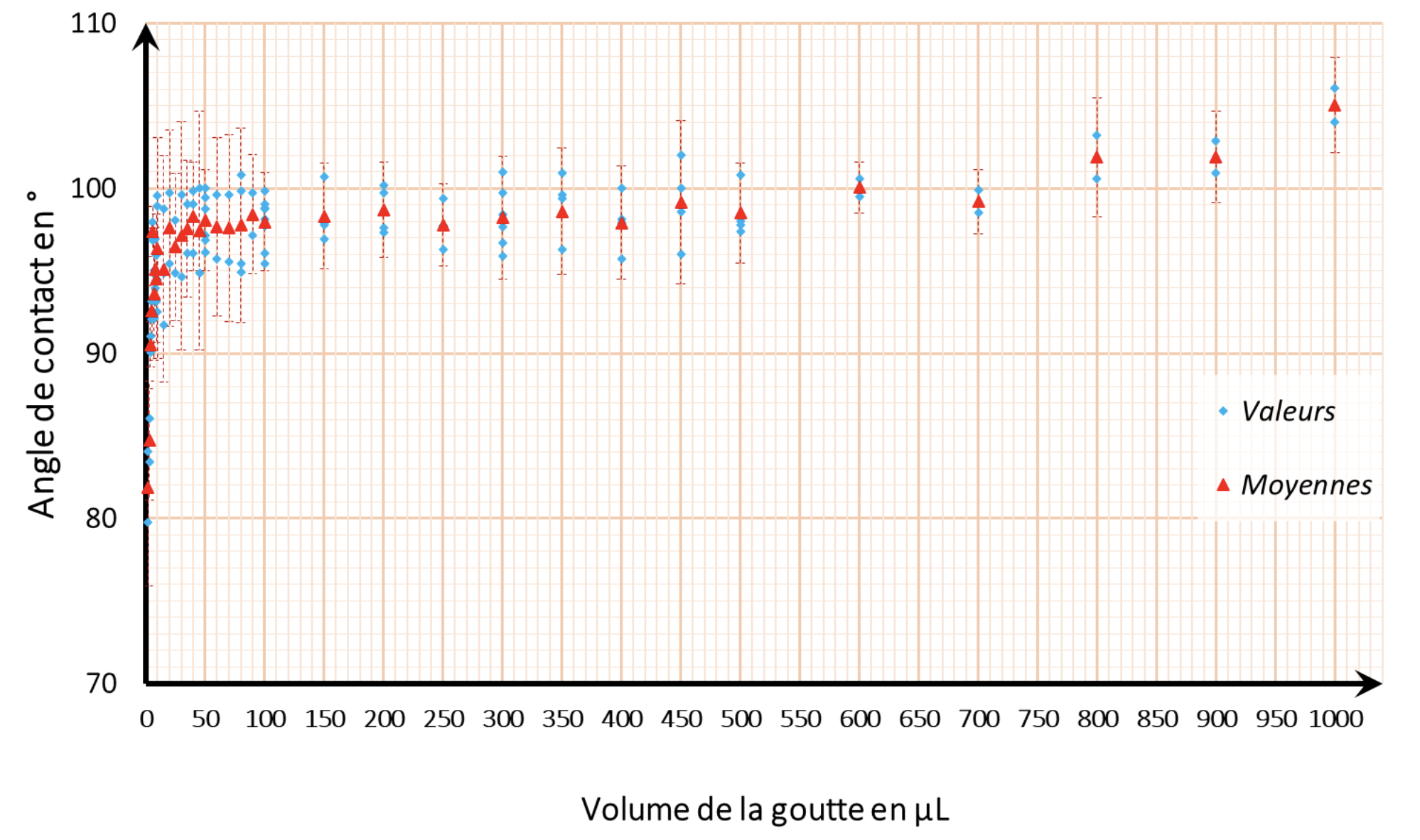
Nos résultats sont consignés dans le graphique figure 11. Les valeurs mesurées sont en bleu et l'angle moyen est représenté en rouge avec une barre d’erreur à ±1,96 écart-type (seuil à 95%).
Sur la figure 11, nous observons qu'au-delà de 550 μL, le volume déposé a une influence sur la valeur de l'angle de contact. C'est comme si la masse d'eau formait une flaque plutôt qu’une goutte.
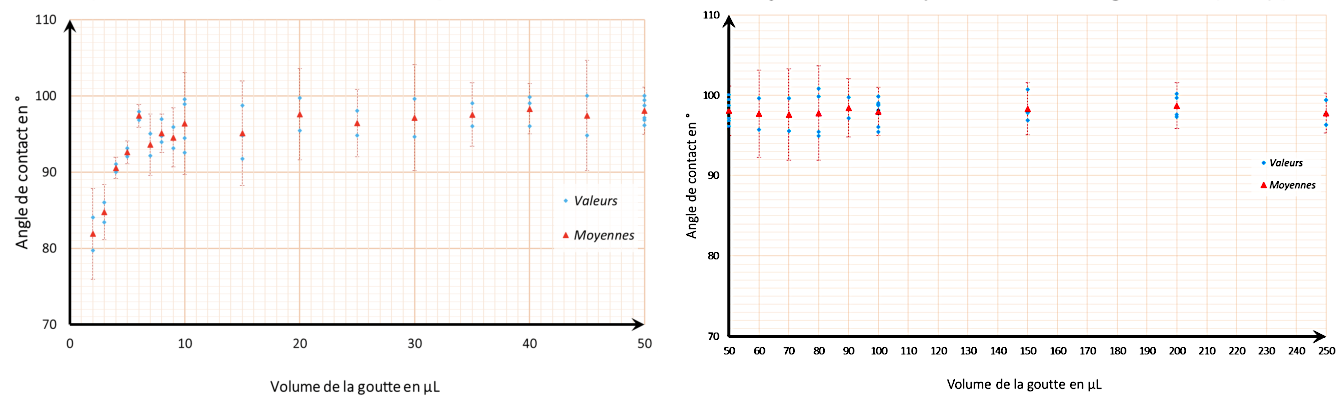
Zoomons maintenant sur la courbe pour observer les plus petits volumes, figure 12.
De 2 μL à 25 μL, l'angle change de manière importante en fonction du volume. La masse d'eau est faible, les forces de tension superficielle prennent le pas sur la gravité. Nous pensons également que pour de très petits volumes, l'angle est très sensible aux conditions de dépôt.
Par contre entre 40 μL et 250 μL l'angle est peu affecté par le volume d'eau déposé. Nous aurions peut-être dû multiplier les valeurs dans cette zone pour espérer réduire l’amplitude des barres d’erreurs.
En conséquence, nous avons choisi de toujours faire des dépôts de 50 μL pour nos mesures. C’est aussi le volume d’une goutte de burette (on considère généralement qu’il y a 20 gouttes dans 1 millilitre).
1.5 Résultats des mesures d'angles
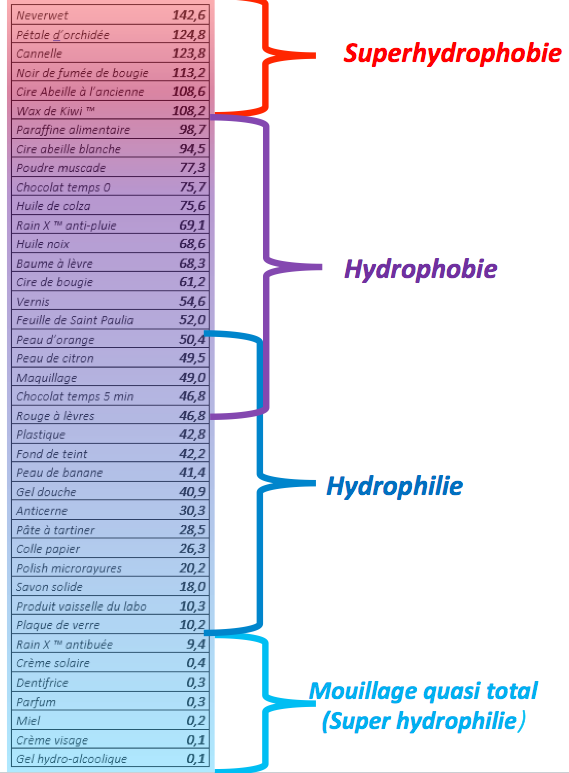
Nous avons réalisé des mesures des angles de mouillage pour un grand nombre de substrats, à l’aide du logiciel Image J. Puis nous avons fait la moyenne arrondie au degré près. Nous avons reporté nos résultats dans le tableau figure 13.
On observe bien une très grande variété de comportements de l’eau vis-à-vis des surfaces. Nous pensons que le cas de la superhydrophilie est lié à la dissolution de molécules tensio-actives qui diminuent la tension superficielle de l’eau [ref1].
Nous notons que ces valeurs ne sont pas des constantes, car elles dépendent des conditions de l’expérience et de l’état de surface. Nous remarquons aussi que l’angle « à droite » n’est pas toujours égal à l’angle « à gauche » même si nous avons pris la précaution d’avoir une plaque horizontale. Nous avons choisi de toujours travailler avec des lames de verre neuves sortant de l’emballage. Nous posons comme hypothèse qu’elles ne sont pas contaminées chimiquement et que l’état de surface est régulier.
Nous avons également remarqué que le dépôt doit se faire en une seule fois. En effet, si l'on ajoute ou que l'on retire un petit peu de liquide l’angle est modifié. Selon M. José Bico, on parle d’hystérésis [ref5].
2. Du chocolat à la couronne
2.1 L'expérience fondatrice avec le chocolat
Le TP initial de notre professeur se terminait en nous demandant d’essayer avec un substrat que nous avions sous la main. La séance avait lieu entre 16h et 17h30, nous étions nombreux à avoir sous la main une barre chocolatée puisque c’était l’heure du goûter ! Sans hésiter, nous avons été nombreux à essayer d’y déposer une goutte d’eau pour voir le résultat obtenu. Nous avons bien fait car c’est assez surprenant, comme le montrent les photos figure 14.
Nous avons pu observer que le profil de la goutte évoluait au cours du temps. La goutte s'étale, l'angle d'Young diminue, l’eau mouille de plus en plus un substrat qui semble devenir de plus en plus hydrophile puis on voit apparaître des dépôts en périphérie.
Nous avons alors cherché à comprendre ce phénomène !
2.2 Le beurre de cacao
Le chocolat n'est pas un corps pur. Est-ce que l'évolution de l'angle de contact est lié aux matières grasses qui le composent ? Nous nous sommes procuré du beurre de cacao puis nous avons réalisé le test, figure 15.
|
Figure 15. Goutte d'eau sur du beurre de cacao |
Mais le profil n’évolue pas et l’angle de Young reste constant et égal à 56°.
Nous souhaitions essayer de poser une goutte sur un crital de sucre mais les cristaux de sucre candi que nous avions à notre disposition avaient des faces rayées qui présentaient des irrégularités. Finalement nous avons décidé de renverser le problème et d'observer l'évolution du profil d'une goutte saturée en sel qui s'évapore sur un substrat.
2.3 Étude de l'évaporation d'une goutte d'eau salée sur un support
Nous avons réalisé une solution saturée de chlorure de sodium en mélangeant dans un erlenmeyer bouché, 100 g de sel avec 200 g d’eau distillée. Nous avons laissé sur agitation pendant une heure, puis laissé reposer une semaine. Le mercredi suivant, nous avons filtré la solution saturée (de solubilité 360 g.L-1).
Nous avons déposé des gouttes de 50 μL à 200 μL sur différents supports. Le résultat est sensiblement le même quel que soit le support.
On s’aperçoit que pour une solution non saturée, il apparaît très rapidement des cristaux de manière aléatoire. La solution est très instable : à la première perturbation, il y a cristallisation, peut-être aurions nous dû être plus prudentes vis-à-vis de la présence de poussières.
Pour une solution saturée, on aboutit toujours à la formation d’une couronne à la périphérie de la goutte. Lorsque l’on coupe cette structure fragile, on s’aperçoit qu’elle est creuse comme le moule d’un gâteau couronne : le moule à savarin, figure 16.
|
Figure 16. Évaporation d'une goutte saturé en sel |
Nous avons réalisé des films du séchage de gouttes sur différents supports grâce à l’application TimeLab [ref6]. Les photographies extraites de la vidéo du séchage d’une goutte de chlorure de sodium saturée à une température ambiante de 18,2°C sur un support en polyéthylène sont présentées figure 17.
Nous avons contacté le laboratoire d'océanologie et de géosciences de Wimereux (UMR 8187 LOG) pour réaliser quelques clichés de nos couronnes au microscope électronique, figure 18.
|
|
On y voit bien la structure en couronne, mais aussi des cristaux de sel à l’intérieur.
Intéressons-nous maintenant au processus de formation de la couronne.
Lorsqu'une goutte d'eau est déposée sur un support, du fait que l'air ambiant ne soit pas saturé en humidité, une partie de l'eau s'évapore, figure 19.
|
Figure 19. Évaporation d'une goutte |
Si l’évaporation est uniforme sur toute la surface de la goutte alors il va apparaître un gradient de concentration de sel entre le centre de la goutte et ses bords, figure 20. Les bords de la goutte, plus fins seront donc plus concentrés en sel jusqu'à atteindre la limite de précipitation.
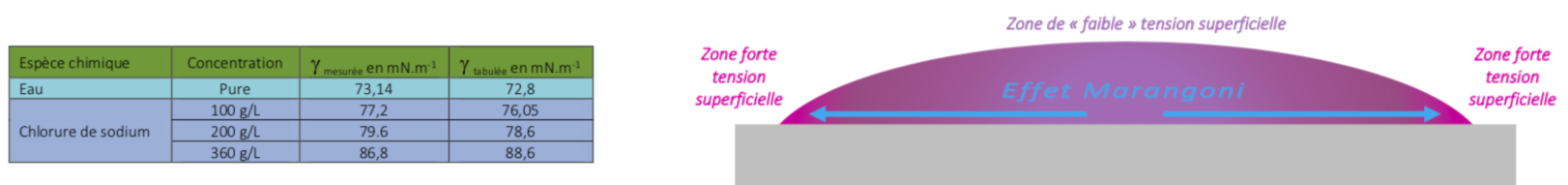
Or la concentration de chlorure de sodium augmente la tension superficielle [ref1], figure 21. Par suite, un gradient de tension superficielle induit l'effet Marangoni [ref7].
La goutte devrait donc s'étaler. Mais ici, elle ne le fait pas car il y a précipitation et donc ancrage de la goutte. Il apparaît des cristaux aux extrémités. Une digue de sel se forme et se développe à mesure que le niveau d'eau baisse dans la goutte, figure 22.
Le chlorure de sodium se dépose exactement à la limite de l'interface comme dans le cas des travaux d'une équipe de l'Institut Lumière Matière à Lyon avec laquelle nous avons échangé. À la différence que, dans leur étude, ils déposent des gouttes d'eau qui sèchent sur des cristaux de sel [ref8], figure 23. Nous retrouvons les même types de profils.
|
a) Couronne ouverte, b) Couronne semi-ouverte, c) Couronne fermée. Source : Mailleur et al. 2018 [ref8]. |
3. La formation en accolade
Toujours dans le prolongement du TP de SL, nous avons eu l’idée de poser une goutte sur un glaçon afin d’observer le comportement de l’eau liquide sur l’eau solide. Cela semble très simple, mais c’est tout l’inverse car les glaçons commencent à fondre dès l’instant où on les extrait du congélateur. Il faut travailler avec des glaçons secs essuyés avec un torchon, sinon, on dépose de l’eau sur de l’eau et on remarque que cela s’étale plutôt très bien.
Pour nous simplifier la vie, nous avons eu l’idée de travailler avec un glaçon réutilisable, utilisé pour rafraîchir une boisson sans la diluer par l'eau de fusion, figure 24. On supposera que tous nos congélateurs sont réglés à -18°C.
|
Figure 24. Glaçons « réutilisables » |
Les résultats sur le groupe de classe divergeaient : de « bof » à « génial, c’est superbe ! » selon le résultat obtenu par chacun, figure 25.
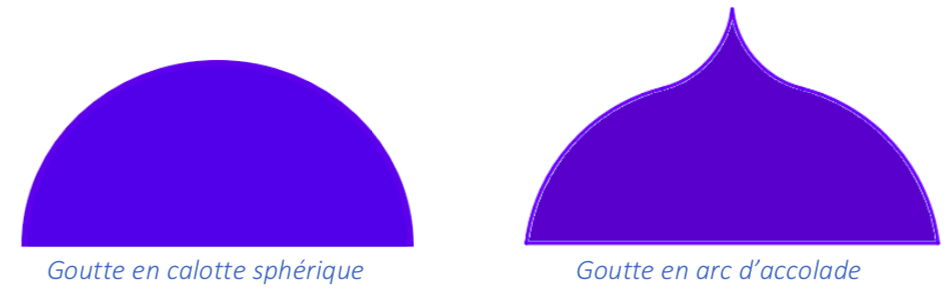
Nous obtenons bien des résultats différents pour une même situation apparente où de l’eau gèle sur un support froid. Intriguées, nous avons cherché à savoir pourquoi nous avions des formes toutes très différentes : de la calotte sphérique prévue, à la formation en accolade, figure 26.
3.1 Étude des paramètres de congélation d'une goutte
À la maison, nous avons utilisé des glaçons réutilisables, d’origines hétérogènes et de natures assez mal connues. Nous avons donc décidé d’utiliser des blocs métalliques de caractéristiques connues. Pour ceci, nous sommes allées voir un professeur de génie mécanique qui nous a proposé des blocs de matériaux différents, figure 27. Parmi les métaux disponibles, le cuivre est le candidat idéal puisque c’est lui qui se réchauffera le moins vite, mais c’est aussi le plus cher. Le fer est aussi un bon candidat d’autant qu’il est possible de l’avoir dans des formes très variables. L’aluminium, qui demande 27% de chaleur en moins à volume égal, présente l’avantage de ne pas s’oxyder facilement et sa surface est toujours plus facile à nettoyer. Nous avons donc choisi de travailler essentiellement avec de l’aluminium en prenant soin de l’isoler thermiquement en le plaçant dans un bac en ploystyrène.
Nous avons donc mis les blocs métalliques au congélateur.
Comme pour l’étude du profil d’une goutte, nous avons choisi de travailler avec de l’eau bidistillée. Mais que choisir comme température initiale de la goutte ?
- La capacité thermique massique de l’eau est de ceau = 4 185 J.K-1.kg-1, c'est-à-dire qu'il faut évacuer 4,18 J pour baisser la température de 1 g d’eau de 1°C.
- La chaleur latente de fusion de l’eau est de Leau = 355 kJ.kg-1 = 355 J.g-1, il faut extraire 355 J de chaleur pour congeler 1 g d’eau.
Nous avons décidé de travailler avec une eau distillée à la température du réfrigérateur du laboratoire : +4°C. Le volume standard déposé est de 50 μL.
Correspondance - comparaison d'énergies
Pour illustrer ces énergies, nous proposons de les comparer aux valeurs équivalentes d'énergie potentielle nécessaire pour soulever une masse de 5 kg.
On a \( E_{p} = mgh\) avec \( m \) = 5 kg et \( g \) = 9,81 m.s-2.
Ainsi, pour refroidir d'1°C, un gramme d’eau il faut évacuer la même énergie que pour lever la masse de 8,5 cm (\( h = \frac{4,18}{5 \times 9,81}\)).
Et pour congeler 1 g d’eau il faut extraire autant d’énergie que pour élever la masse de 7,24 m (\( h = \frac{335}{5 \times 9,81}\)).
Pour étudier l’influence de l’angle de contact initial sur le développement de la goutte gelée, nous avons traité les surfaces pour les rendre plus ou moins hydrophiles/phobes. Nous avons écarté les produits végétaux et alimentaires (sauf les huiles), ainsi que les produits super-hydrophiles. Nous disposions d’une gamme d’angles allant de 18° à 142°. Nous avons étalé le produit en prenant bien garde d’avoir une épaisseur constante pour ne pas avoir de trous ni de rayures ou de bosses. Nous avons réalisé notre dépôt en une seule fois.
La figure 28 présente la congélation d'une goutte sur une surface en acier traitée avec de la cire d'abeille blanche (T=-17,4°C).
|
|
Grâce à la présence du colorant alimentaire, on voit la progression du front de congélation. On voit que la solidification de l’eau est progressive et que l’apparition de la pointe ne se fait que dans les dernières secondes. On passe progressivement de la calotte sphérique à une forme en d’accolade, figure 29.
3.2 Suivi du front de cristallisation
Pour suivre le front de cristallisation de la goutte, nous avons eu l’idée de prélever régulièrement des images de nos vidéos pour pointer le pourtour de la goutte et la position du front de congélation. Nous avons utilisé Regavi [1] , conçu pour fonctionner avec Regressi.
Nous avons choisi arbitrairement de prendre comme origine le point de contact gauche de la goutte et comme unité de longueur la largeur initiale de la goutte.
Nous avons ainsi récupéré les coordonnées du pourtour de la goutte et de la ligne de solidification à différentes dates puis nous les avons transférées dans Excel.
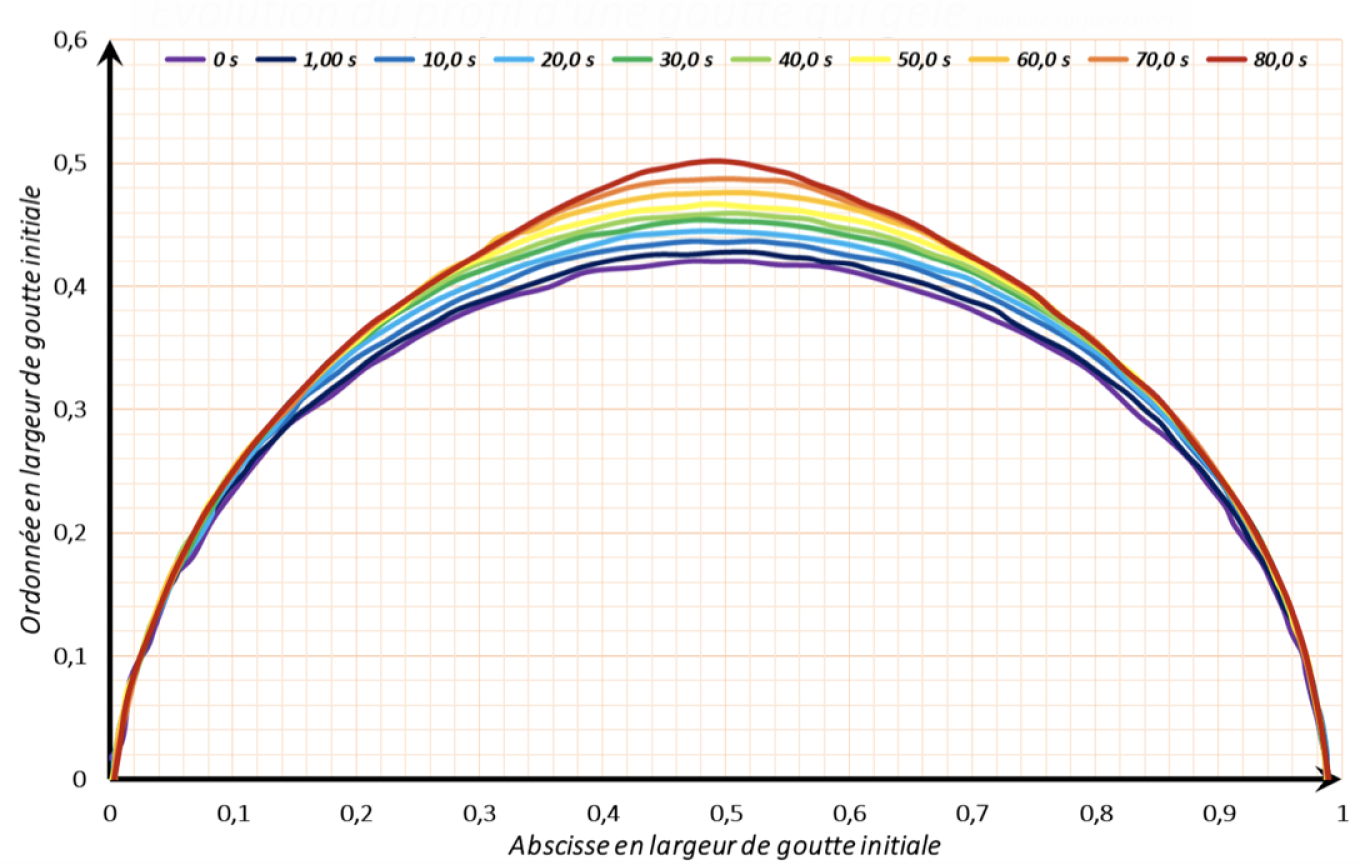
Le tracé est présenté figure 30.
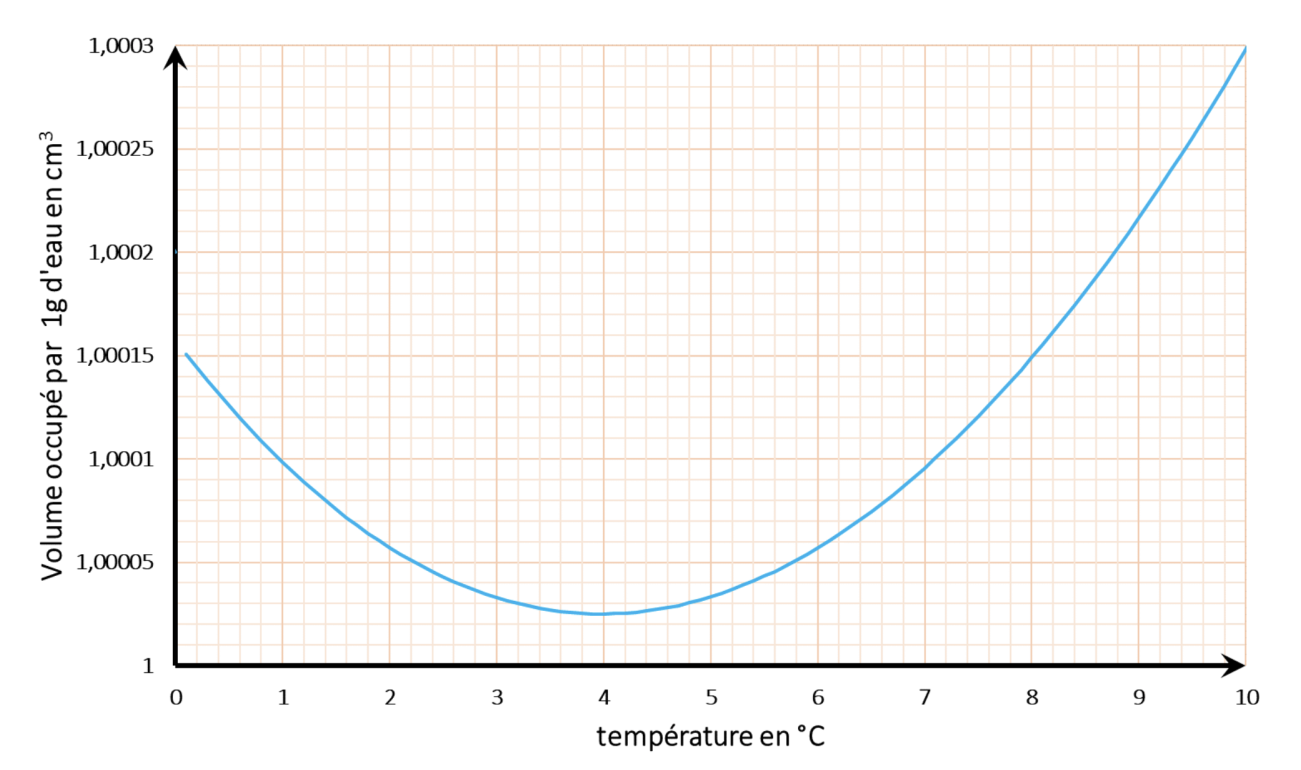
Nous remarquons que dans un premier temps la goutte gonfle, sa hauteur augmente de manière significative alors que nous ne voyons pas de glace apparaitre. Nous pensons que c’est lié à la dilatation de l’eau entre 4 et 0°C, figure 31.
Ensuite on peut expliquer l’augmentation du volume par le simple fait de la présence de la glace, l’eau gelée occupe plus d’espace que l’eau liquide (μeau liquide à 0,1°C = 0,9998 g.cm-3 et μglace à 0°C = 0,9167 g.cm-3)
Pendant cette phase, figure 30, la goutte gagne près de 10% en hauteur. C’est quasi l’écart des valeurs de masses volumiques.
Intéressons-nous maintenant au front de cristallisation, figure 32.
|
|
Le front de cristallisation progresse approximativement de manière parallèle à la surface de contact. La progression est plus rapide au début, en effet, la conductivité thermique de l'Aluminium est plus grande que celle de la glace. Une fois que la glace isole thermiquement l’eau de l’Aluminium, on observe bien que le transfert thermique par conduction est ensuite moins efficace.
λAluminium = 237,63 W.m-1.K-1 >> λGlace = 2,206 W.m-1.K-1 >> λEau = 0,607 W.m-1.K-1
L’apparition de la pointe entre 80 s et 87 s ne fait pas l’unanimité dans nos échanges avec les scientifiques. Il semblerait que lorsque le volume occupé par l’eau est trop petit pour être occupé par de la glace seule alors les forces de tensions superficielles deviennent négligeables et la cristallisation se poursuit dans la même direction.
Une vidéo de congélation d'une goutte est présentée en temps réel, figure 33.
|
Figure 33. Congélation d'une goutte en temps réel (support à -17°C) On peut suivre le front de cristallisation en rouge "plus clair", du bas vers le haut de la goutte. |
4. Conclusion
Dans un premier temps, nous avons eu l'occasion de remarquer que l’angle de Young d’une goutte d’eau sur un carré de chocolat varie au cours du temps. Nos expériences nous ont révélé que cela ne provenait pas du beurre de cacao qui, seul, ne fait pas varier cet angle. Nous avons ensuite déposé une solution saline sur différentes surfaces, pour découvrir lors du séchage l'apparition de couronnes de sel : le support NaCl, une fois la dissolution faite, ne sert plus que de support plutôt hydrophile. L’évaporation uniforme permet alors l’apparition de gradient de concentration ce qui entraîne une zone plus concentrée à la périphérie. Arrivée à saturation, la tension superficielle augmente aux extrémités et entraîne l’effet Marangoni. Grâce à la précipitation, la goutte ne s’étale pas. La surface devient alors concave. Le chlorure de sodium se dépose à la limite de l’interface.
Comme nous l’avons montré dans notre projet, l’angle de mouillage d’une goutte d’eau (angle de Young) varie énormément en fonction de la surface sur laquelle elle est déposée. Le mouillage peut être total (super-hydrophile) à nul dans le cas de la super-hydrophobie. Après nos nombreux essais sur différentes surfaces, les cas du chocolat et celui de la surface froide nous ont interpellés par leurs résultats exceptionnels.
Dans un second temps, nous avons découvert qu'une goutte d’eau déposée sur une surface froide commence à geler par le bas. Elle va se dilater verticalement. Le liquide se retrouvant sur le solide se déplacera vers le haut en devenant solide jusqu’au dernier point où il formera donc un dôme pointu, la pointe est aussi liée au dépassement de la tension superficielle de la goutte sur son poids.
L'effet du dépôt d'une goutte sur un glaçon réutilisable nous a interpellées. Étonnées par nos différents résultats de gouttes en arc d’accolade, nous avons alors creusé dans cette voie. Nous avons étudié des matériaux et effectué des calculs, pour avoir les meilleures conditions. Ainsi en étudiant les différents angles de mouillage nous avons remarqué que tous nos résultats partaient de là.
Nous nous sommes rendues compte que si nous partions d'une surface très hydrophile comme par exemple de la crème nous n'aurions aucune chance d'obtenir une forme en accolade, contrairement à une surface hydrophobe pour laquelle on aura de très grandes chances d'obtenir ce résultat.
Ces différents phénomènes observés et étudiés peuvent paraître futiles. Mais c'est avant tout de la recherche fondamentale, motivée par la compréhension d'un phénomène naturel. Ces questions sont étudiées dans les sciences forensiques pour dater un phénomène ou la paléoarchéologie pour connaître les conditions d'une paléo-goutte. Les accolades sont impliquées dans la forme de cristallisation de semi-conducteurs le séchage d’encre 3D.
Références
- [1] À la force d'une goutte, Margaux Maréchal, Joséphine Piret, Ophélie Trupin, Cédric Magnier et Chad Lepecuchelle, Olympiades de Physique 2019.
- [2] La caléfaction froide, Laurine Andrieux, Maxime Frey, Théo Deknuydt, Olympiades de Physique 2015.
- [3] ImageJ est un logiciel libre d’analyse et de traitement de l’image.
- [4] Plugin Contact Angle, pour le logiciel ImageJ.
- [5] Page personnelle de José Bico, PMMH, ESPCI.
- [6] Application Android, TimeLab, existe en version gratuite et payante (2,59€ à 4,19€ selon les options choisies).
- [7] Opération margueritte, Laurie Azoulay, Stéphane Branly, Juliette Chavalle et Adrien Leroy, Olympiades de Physique 2018.
- [8] Hollow Rims from Water Drop Evaporation on Salt Substrates, Alexandra Mailleur, Christophe Pirat, Olivier Pierre-Louis et Jean Colombani, Phys Rev Lett. 21 nov 2018, 121(21):214501.
Pour citer cet article :
Des gouttes qui sèchent ou qui gèlent - De la couronne à l'accolade, Aurore Maréchal, Candice Mailly, Clara Defretin, Erynne Lefebvre, Julietta Schleidler, mai 2022. CultureSciences Physique - ISSN 2554-876X, https://culturesciencesphysique.ens-lyon.fr/ressource/goutte-gelee-Olympiades.xml