Activer le mode zen
Ressource au format PDF
Mots-clés
Classification
Pourquoi la glace se forme-t-elle d'abord en surface ?
26/09/2005
Résumé
Pourquoi la glace se forme-t-elle d'abord en haut, et l'huile se solidifie-t-elle d'abord par en bas ? Que se passerait-il avec d'autres liquides ?
On va s'efforcer de répondre en quelques mots à cette question que l'on s'est posée il y a quelques jours...
En règle générale, la densité d'un corps augmente lorsque sa température diminue : ainsi, dans la majeure partie des cas, plus un liquide est froid, plus il est dense, et à l'état solide un corps est aussi généralement plus dense qu'à l'état liquide. Or, l'eau représente une exception à cette règle : si, à température ordinaire, l'eau devient plus dense lorsque la température diminue, cette tendance s'inverse entre 4°C et 0°C : à partir de 4°C, l'eau se dilate en se refroidissant, et la glace elle-même est moins dense que l'eau. C'est parce que la glace est moins dense que l'eau qu'elle flotte sur l'eau... C'est aussi pour cela que l'eau gèle d'abord par le dessus.
Figure 2. Un glaçon à la surface de l'eau
Lorsque la température extérieure est d'une vingtaine de degrés, par exemple, en l'absence de courant marin ou de conditions particulières, l'eau profonde en mer est plus froide que l'eau de surface. Cependant, lorsque la température extérieure est très basse (près de 0°C), l'eau la plus froide, moins dense, a tendance à monter en surface, et lorsque la température descend en-dessous de 0°C, c'est cette eau de surface qui gèle en premier.
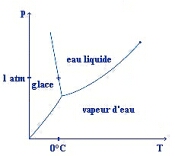
Figure 3. Diagramme de phase de l'eau
Le diagramme de phase de l'eau montre que l'eau gèle à des températures plus basses lorsque la pression augmente : ce comportement est directement relié (via des formules de thermodynamique) au comportement signalé plus haut, c'est-à-dire la diminution de la densité de l'eau lorsqu'elle refroidit...
Ce comportement de l'eau est une "anomalie"
L'huile, on l'a vu, a tendance à geler d'abord en profondeur car l'huile la plus froide est aussi la plus dense, et se retrouve donc tout naturellement en bas du récipient. Le cas de l'eau est une exception, une "anomalie" due à sa structure particulière : sous forme de glace, elle forme généralement* une structure tétraédrique moins compacte que sa structure à l'état liquide et à basses températures. La densité de l'eau augmente donc lorsqu'elle fond. Elle ne diminue qu'au-delà de 4°C environ, à cause de l'agitation thermique des molécules.
en fait, l'eau peut cristalliser suivant d'autres structures, mais ce ne sont pas des structures que l'on obtient dans les conditions usuelles de cristallisation.
Figure 4. Glace à la surface d'un lac
Cette propriété remarquable de l'eau est plus qu'une "bizarrerie" amusante... La glace qui se forme en surface d'un lac ou d'une rivière l'hiver protège l'eau en-dessous du froid, permettant ainsi à celle-ci de rester liquide, et à la vie aquatique de persister... Imaginez, si la glace se formait d'abord au fond de l'eau, pour s'épaissir au fil de l'hiver et finir par occuper tout le volume du lac... La vie aquatique serait impossible!
Pour en savoir plus, voir cet article du CNRS sur l'eau.
La science ne marche pas toujours comme on l'attendrait!...
Lorsque cette page a été écrite, il a fallu faire quelques photos. Connaissant le comportement de l'eau et de l'huile pour l'avoir constaté à de nombreuses reprises, l'auteur pensait qu'il serait facile de reproduire tout cela à l'intérieur de son freezeur. Malheureusement, quelques temps après avoir mis l'eau au freezeur, celle-ci avait partiellement gelé... et la glace se trouvait au fond du récipient et non sur le dessus ! Le fond du récipient était en effet en contact avec la plaque très froide du freezeur...
Qu'à cela ne tienne, il suffit donc de poser le récipient sur une série de couvercles en plastique servant d'isolant. Malheureusement, force a été de constater que, dans ces circonstances, la température du freezeur était insuffisante à faire geler l'eau du récipient. Craignant un phénomène de surfusion, l'auteur de cet article a secoué le récipient à plusieurs reprises : l'eau est restée liquide. Alors, un petit morceau de glace a été jeté dans l'eau du récipient... c'est alors que le contenu entier du récipient a été instantanément changé en glace... Il y avait bien surfusion.
Moralité : la nature se moque de savoir quel phénomène physique vous vouliez illustrer...
Pour ceux qui veulent voir une petite vidéo sur le phénomène de surfusion, cliquez ici ! Un clic droit de la souris vous permet d'ouvrir la vidéo dans une nouvelle fenêtre (recommandé)... En sortant un récipient rempli d'eau du freezer et en lançant un glaçon à l'intérieur, il est possible de voir le phénomène de surfusion se produire au ralenti, plutôt que de façon quasi-instantanée. Des aiguilles de glace se forment petit à petit dans le verre, et, à la fin, en le filmant de dessus, on voit que sa surface est gelée.
P.S.: la surfusion, phénomène connu depuis longtemps, a tendance à enflammer l'imagination : ainsi, dans "Hector Servadac", Jules Verne présente un morceau la Terre, avec une partie de la mer Méditerranée, qui aurait été emporté dans l'espace... Ce morceau de mer reste liquide à une température inférieure à 0°C, mais gèle instantanément dans son intégralité lorsqu'une pierre est jetée dans l'eau.
Pour citer cet article :
Pourquoi la glace se forme-t-elle d'abord en surface ?, Gabrielle Bonnet, septembre 2005. CultureSciences Physique - ISSN 2554-876X, https://culturesciencesphysique.ens-lyon.fr/ressource/QSglaceSol.xml