Activer le mode zen
Ressource au format PDF
Mots-clés
Classification
L'énergie - Aspects généraux (1/2)
21/01/2019
Résumé
Présentation de la notion d'énergie, conversion d'énergie et définition des unités.
Table des matières
1. Définition de l'énergie
L'énergie est un concept central en physique, en chimie en biologie, ainsi qu'en géologie et dans les sciences de l'Univers. La notion d'énergie est donc naturellement sous-jacente à de nombreuses préoccupations de la vie quotidienne. Par exemple lorsque l'on évoque la valeur énergétique d'un aliment, la consommation électrique d'un foyer ou en carburant d'un véhicule, le rendement d'un panneau solaire. À une plus grande échelle, ce sont les ressources énergétiques en pétrole, gaz ou charbon qui participent au pouvoir économique d'un pays et déterminent son influence internationale.
Bien qu'étant le moteur de toutes les évolutions ou transformations [1], l'énergie reste toutefois peu aisée à définir. Sans doute parce qu'elle ne se manifeste qu'à travers ses variations. Par exemple, l'énergie chimique d'un mélange carburant-comburant (les réactifs) ne se « convertit » en chaleur que lorsque la réaction exothermique s'est produite, conduisant à de nouveaux composés chimiques (les produits). L'énergie thermique « libérée » est égale à la variation des énergies d'interaction entre les atomes des réactifs et ceux des produits.
Dans le cas d'une réaction exothermique, nous dirons que les produits sont plus « stables » que les réactifs. De même, l'énergie d'origine élastique emmagasinée par un ressort comprimé ne se manifeste qu'à sa libération, lorsqu'il se détend, en induisant des effets mécaniques.
Nous définirons alors l'énergie plutôt à travers les effets qu'elle peut produire. Ainsi, l'énergie est une entité physique susceptible (c'est-à-dire, si certaines conditions sont réunies), de produire de la chaleur ou induire un mouvement. La notion de mouvement étant à envisager au sens large ; ce peut être le déplacement d'un corps mais également celui d'électrons produisant un courant ou encore celui de particules diffusantes mues erratiquement par l'agitation thermique.
2. Unités
Le caractère général de l'énergie implique qu'elle s'exprime par la même unité, en l'occurrence le joule [2] (J), dans le Système international d'unités, indépendamment du domaine de la physique considéré. Notons cependant que, dans certaines situations [3], il apparaît plus commode d'utiliser des unités de conversion. Par exemple, le kilowatt-heure (kWh) est l'unité d'usage dans les domaines industriel et domestique, l'électronvolt (eV) dans celui de l'atomistique, la calorie (cal) dans celui de la diététique et parfois celui de la thermodynamique. D'autre-part, afin de l'adapter à la gamme des ordres de grandeur concernés, on utilise les multiples et sous-multiples habituels (μJ, mJ, KJ,...). Le joule est une unité dérivée des unités de base du Système international d'unités, les unités de masse, de longueur et de temps.
3. Nature de l'énergie
L'énergie représentant une même grandeur, sans distinction des phénomènes physiques auxquels elle se rapporte, il peut parfois paraître plus clair, notamment dans le cas d'une conversion (ou d'une transformation), d'indiquer son origine (ou sa nature). Par exemple, on précisera « énergie d'origine thermique », voire plus simplement « énergie thermique ». Notons que cette dernière dénomination est un abus de language qui oblitère le caractère général de l'énergie.
L'énergie peut ainsi se présenter sous différentes formes (ou natures) : mécaniques (potentielle et cinétique), électromagnétique (englobant l'électrocinétique), thermique, chimique, atomique, nucléaire. Notons toutefois qu'il ne s'agit que d'une classification pratique ; l'énergie potentielle emmagasinée par un ressort est la manifestation, à l'échelle macroscopique, des phénomènes d'interaction atomiques d'origine électromagnétique et quantique, l'énergie thermique celle du mouvement brownien des particules ou des atomes.
L'énergie possède la propriété remarquable de pouvoir être échangée entre deux (ou plusieurs) systèmes en interaction, tout en conservant globalement sa quantité. Cette propriété est traduite, de la façon la plus générale, par le premier principe de la thermodynamique. Il stipule que la variation d'énergie interne [4](∆U) à un système est égale à l'énergie reçue de l'extérieur (c'est-à-dire de tous les systèmes avec qui il est en interaction), sous forme de travail (W) ou de chaleur (Q).
Il s'écrit : ∆U = W + Q
Toute en se conservant, l'énergie peut changer de nature, par « conversion » (ou « transformation »). Cette propriété est mise à profit dans divers dispositifs techniques de conversion dont les applications sont multiples. Par exemple, un moteur thermique réalise la conversion d'énergie d'origine chimique (carburant et comburant) en énergie de nature mécanique, un moteur électrique celle d'énergie d'origine électrique (fournie par un générateur – qui réalise également, en amont, une conversion d'énergie) en énergie de nature mécanique. Ces dispositifs sont appelés des « convertisseurs d'énergie ». Pour insister sur le caractère universel de l'énergie, soulignons encore qu'il serait plus juste de les dénommer « convertisseurs de nature d'énergie ». Notons qu'il existe des dispositifs de conversion particuliers, tels qu'un transformateur électrique ou une boîte à vitesses, qui ne modifient pas la nature de l'énergie mais agissent sur les grandeurs physiques qui la composent.
En pratique, la conversion d'une nature d'énergie d'entrée (représentée par la variable Ee) en celle que l'on souhaite obtenir en sortie (représentée par la variable Es) ne s'effectue pas sans dégradation (ou « perte »). Cela signifie qu'une partie de l'énergie intiale s'est parallèlement convertie en une autre forme, voire en plusieurs autres formes, (représentée par la variable Ep) que celle souhaitée. La notion de conservation de l'énergie doit donc être interprétée au sens large, en comptabilisant toutes les composantes de l'énergie en sortie.
4. Conversion de l'énergie, rendement
Pour caractériser la qualité d'une conversion (ou d'un convertisseur) on introduit la notion de rendement qui compare l'énergie de sortie (souhaitée) à l'énergie d'entrée par le rapport η ≡ |Es|/|Ee|.
La condition de conservation de l'énergie se traduit par l'égalité Ee = Es + Ep.
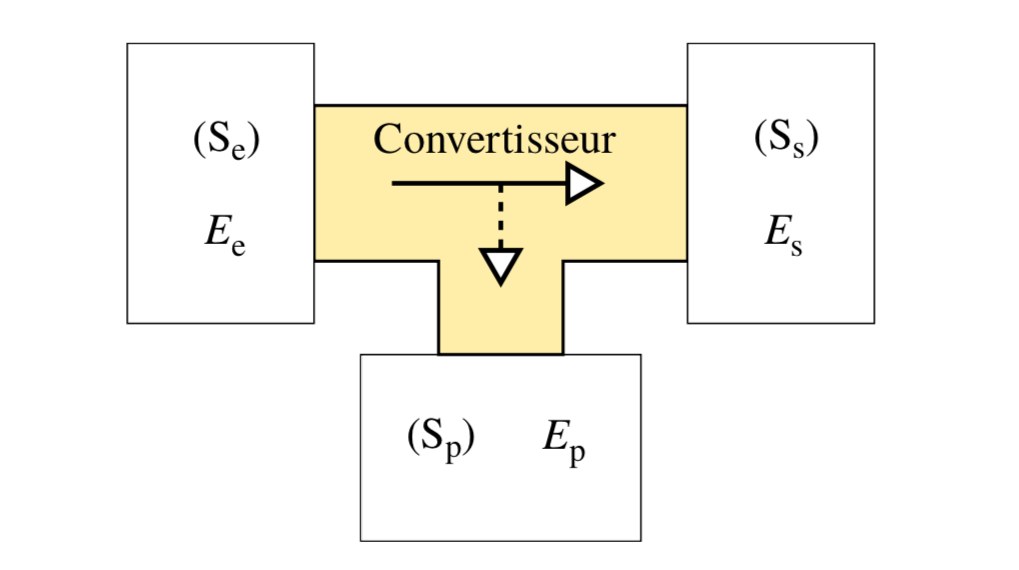
On appelle « bilan » une relation s'appyant sur la propriété de conservation de l'énergie. On l'appuie généralement sur un schéma tel que celui [5] représenté figure (1).
L'énergie se conservant[6], les différentes formes d'énergie qui sont utilisées au niveau d'un foyer ou dans l'industrie sont généralement le résultat d'une série de transformations. Dans l'évolution des formes d'énergie on distingue d'abord les sources d'énergie primaire (renouvelable ou non), potentiellement disponibles dans la nature (énergies fossiles, mécaniques [cours d'eau, marée, éolien], géothermique, solaire et nucléaire). Bien que l'énergie d'origine mécanique (moulin) ou solaire (panneau photovoltaïque ou panneau chauffe-eau) puisse être directement utilisée, ces énergies primaires sont généralement transformées en énergies secondaires afin d'être transportées et plus aisément utilisables par les consommateurs (au sens large). L'énergie secondaire la plus facile à distribuer est, naturellement, l'énergie électrique. Notons que l'énergie mécanique disponible dans les cours d'eau ou les vents trouve son origine dans l'énergie solaire par le concours de processus complexes (évaporation-condensation, convection) de conversion primaire. L'énergie solaire est elle-même le produit de réactions nucléaires au cœur du Soleil (fusion de l'hydrogène en hélium)...
En réalité, lors d'une conversion, ce ne sont pas les énergies d'entrée et de sortie qui interviennent directement, mais leur variation. Si l'on suppose que le convertisseur est relié à son entrée à un système (Se) fermé et isolé d'énergie Ee (d'une certaine nature) et à sa sortie à un autre système (Ss) fermé et isolé d'énergie Es (de la même ou d'une autre nature). Le système d'entrée échange de l'énergie avec le convertisseur et, parallèlement, ce dernier échange de l'énergie avec le système de sortie. Le convertisseur permet à l'énergie de transiter (plus précisément de changer de nature) depuis le système d'entrée vers le système de sortie.
Le bilan de conservation de l'énergie s'écrit [7] alors ∆Ee = ∆Es + ∆Ep.
Puisque ce sont les variations d'énergie qui interviennent, les énergies peuvent être mesurées (ou comptabilisées) par rapport à une référence arbitraire qui définit alors une origine des énergies. Pour cette raison, on dit que l'énergie est définie « à une constante près ».
La figure (2) illustre une situation d'échange d'énergie entre les systèmes d'entrée et de sortie et le système bénéficiant des pertes (le plus souvent, il s'agit du milieu environnant), par l'intermédiaire d'un convertisseur.
Avant d'établir un bilan d'énergie, il faut préalablement identifier quels changements de nature d'énergie le convertisseur accomplit. L'énergie d'un système comprend diverses composantes : mécaniques (potentielle et cinétique), électromagnétique, thermique, chimique et nucléaire qu'il faut a priori comptabiliser dans un bilan. Très souvent, les échanges et conversions d'énergie n'opèrent seulement que sur quelques composantes laissant les autres neutres. On ne prendra alors pas en compte les composantes de l'énergie qui n'ont pas participé aux échanges ou à la conversion.
Par exemple, dans la conversion hydroélectrique, les molécules d'eau constituant le flux qui met en rotation les turbines ne sont pas dissociées, ni n'entrent en réaction chimique, lors de la conversion d'énergie. L'énergie chimique restant constante elle ne sera donc pas prise en compte dans le bilan. Il en est de même pour les énergies atomique (les atomes ne se ionisent pas) et nucléaire (les noyaux ne se modifient pas). Avant d'établir un bilan, il apparaît ainsi nécessaire de juger (a priori) quelles composantes de l'énergie participeront aux échanges et la conversion.
En d'autres termes, il s'agit de préciser quelles échelles [8] doivent être prises en compte. Par exemple, dans l'étude d'un système mécanique, on ne s'intéresse qu'aux positions et vitesses des divers éléments qui le composent. Lors de son évolution, des transferts s'établissent entre les énergies potentielle (liée aux positions) et cinétique (liée aux vitesses). Ces échanges sont nécessairement accompagnés de pertes qui se manifestent ultimement par un échauffement du système lui-même, ou du mileu l'environnant. Notons que l'augmentation de température n'est autre que la traduction, à l'échelle macroscopique, de celle de l'agitation thermique. De l'énergie a donc transité de l'échelle du système mécanique à une échelle inférieure, en l'occurrence celle relative au mouvement des atomes. Cette cascade d'échelles présente la particularité d'être irréversible. Par exemple, chauffer un pendule, ou l'air l'environnant, ne mettra pas le pendule en mouvement.
Nous pouvons inventorier les différentes composantes de l'énergie (et les échelles qui leur sont associées) :
- Composante mécanique : énergies de natures potentielle et cinétique d'un système (au sens large, ce peut être un fluide) ;
- Composante thermique : énergie d'agitation thermique des atomes ou des molécules, énergies de rotation et vibrationnelle des molécules ;
- Composante électromagnétique (par exemple le rayonnement) et sa limite électrocinétique pour les régimes quasi-stationnaires ;
- Composante atomique d'interaction des électrons avec leur noyau (rayonnement/absorption ou ionisation) ;
- Composante nucléaire d'interaction entre les nucléons du noyau (radioactivité).
5. Puissance
Un convertisseur est caractérisé, comme nous l’avons évoqué, par son rendement. S'il renseigne sur la qualité de la conversion, il ne donne aucune indication sur la quantité d'énergie mise en jeu, grandeur qui intéresse en premier lieu l'utilisateur.
Pour compléter la caractérisation d'une conversion, on introduit la notion de puissance, définie comme une variation d'énergie par unité de temps. Il s’agit d'un débit d’énergie, son unité est donc le J·s-1, appelé le watt W). Cette grandeur met en relation la variation d'énergie nécessaire pour produire un effet souhaité et la durée nécessaire à son accomplissement.
6. Application : élévation de la température d'un litre d'eau
Par exemple, déterminons le temps nécessaire pour élever la température d’un litre d’eau (de masse m =1 kg) de 20°C à 100°C (∆T), lorsqu’il reçoit une puissance de 100 W (P). Notons C la capacité thermique massique [9] de l’eau liquide (C = 4,2.103 J·kg-1·K-1)[10].
- Énergie nécessaire au chauffage : Ec = mC∆T ~ 3,4.105 J ;
- Durée de la chauffe : ∆tc = Ec / P ~ 3400 s.
Avec une telle puissance (de l'ordre de celle d'une ampoule électrique à incandescence), il faut presque une heure pour atteindre la température d'ébullition. Si l'on souhaite descendre cette durée à une minute, il faut multiplier la puissance[11] par environ 60, ce qui s'élève à 6kW.
Complétons ce calcul en exprimant, toujours pour une puissance de 100 W, la durée d'évaporation d'un litre d'eau bouillante. Il faut alors faire intervenir la chaleur latente de vaporisation massique Llv (2,3.106 J.kg-1) de l'eau.
- Énergie nécessaire à l'évaporation : Elv = mLlv ~ 2,3.106 J ;
- Durée d'évaporation : ∆tlv = Elv / P ~ 2,3.104 s (un peu plus de six heures).
L’eau possède une capacité thermique et une chaleur latente de vaporisation élevées, de plus elle est présente sur Terre en grande quantité. C’est pouquoi elle joue un rôle essentiel, comme thermostat, dans la régulation climatique.
Définissons la capacité thermique (massique à pression constante) et la chaleur latente massique de changement d’état (ici de vaporisation) :
La capacité thermique massique à pression constante est la quantité d’énergie qu’il faut fournir à un kilogramme du corps considéré pour élever sa température de un degré K (ou °C), tout en maintenant sa pression constante. Cette énergie est emmagasinée dans les différents degrés de liberté internes accessibles aux atomes : mouvement brownien ou vibration des atomes ou molécules, rotation et vibration interne des molécules. Cette grandeur dépend a priori de la température et de la pression mais pour l’eau liquide, entre 0°C à 100°C et à la pression de 105 Pa, elle varie de moins de 1%.
La chaleur latente massique de vaporisation est la quantité d’énergie qu’il faut fournir à un kilogramme du corps considéré pour le faire passer de l’état liquide à l’état vapeur (gaz), sous une pression fixée. Dans une phase condensée, par des effets concurrents d’attraction (à longue distance) et de répulsion (à courte distance), il est (énergétiquement) plus favorable que les atomes ou molécules se placent dans un certain voisinage l’un de l’autre. L’énergie apportée permet alors aux atomes (ou molécules) de quitter cet état de proximité[12]. Cette grandeur dépend également de la température et de la pression. Pour l’eau liquide, entre 0°C à 100°C et à la pression de 105 Pa, elle varie de 4%. On notera que l’évaporation ne se produit pas uniquement à l’ébullition. Sur tout le domaine où l’eau liquide existe, les phases liquide et vapeur coexistent, dans un état d’équilibre thermodynamique caractérisé notamment par la pression de vapeur saturante. Sur l’intervalle [0,100] °C, celle-ci croît de 2,3.103 Pa à 1,0.105 Pa (situation d’ébullition).
Article suivant : Exemples d'application et compléments
[1] Entendre ici un processus conduisant d'une situation à une autre.
[2] Du nom du physicien anglais JAMES PRESCOTT JOULE (24/12/1818-11/10/1889).
[3] Ce peut être une trace de l'histoire des sciences. C'est notamment la cas de la « calorie » qui fut définie par le physicien et chimiste NICOLAS CLÉMENT-DESORMES en 1824, avant que JOULE n'établisse l'équivalence entre chaleur et travail, en 1843.
[4] Qui peut être « stockée » sous différentes formes.
[5] Mais qui peut être plus complexe, notamment lorsque l'on souhaite distinguer les différentes causes de pertes, ou que le convertisseur met en relation plus de deux systèmes comme c'est la cas, par exemple, dans une pompe à chaleur.
[6] Entendre par là que l'on peut changer sa nature, aux prix de pertes (au sens que nous avons défini), mais qu'il est impossible d'en « créer ».
[7] Dans ce bilan nous n'avons pas fait intervenir le convertisseur, ce qui suppose que son énergie reste constante.
[8] On peut également parler de degrés de liberté.
[9] Il conviendrait de préciser : capacité thermique massique à pression constante et, par exemple, dans les conditions normales de température et de pression.
[10] Valeur que l’on peut obtenir à partir de la définition de la calorie.
[11] En supposant que l’on peut contrôler l'« injection » de la puissance dans le volume d’eau. Le mode de transfert de l’énergie est déterminé par le principe de chauffage adopté (chauffage par contact puis relai au sein de l'eau par conduction et convection ou chauffage directement en volume par « micro-ondes »), plus ou moins aisément maîtrisable.
[12] On parle de « cuvette de potentiel ».
Pour citer cet article :
L'énergie - Aspects généraux (1/2), Gayvallet, janvier 2019. CultureSciences Physique - ISSN 2554-876X, https://culturesciencesphysique.ens-lyon.fr/ressource/Energie.xml