Activer le mode zen
Ressource au format PDF
Mots-clés
Classification
Des fluides vitreux et résineux à l'électron : l'histoire d'une particule
01/07/2024
Résumé
Cet article présente les contributions de nombreux scientifiques qui ont amenés à la découverte de l'électron.
Table des matières
Premières intuitions de Richarg Laming
Au début du 19e siècle, vivait à Londres un médecin du nom de Richard Laming. Bien qu'admirablement établi, il ne réussira jamais à se ranger dans sa vie de médecin, ses intérêts l'orientant de plus en plus vers le graal des scientifiques de l'époque : l'électricité. Suite à ses premiers travaux cependant, il comprit que la Royal Society et le public anglais dans sa globalité n'était pas disposé à écouter le discours d'un médecin qui semblait avoir des idées pour le moins originales. Il déménagea en France en quête d'un auditorat plus clément.
Il publia à partir de 1838 une série d'articles (tableau 1) donnant une nouvelle description de l'atome, une description qui ressemblait étrangement au modèle que les physiciens élaboreraient par des méthodes scientifiques bien plus tard. Plus étonnant encore : il introduisit la notion de l'électron comme une unité de charge circulant et interagissant en toute indépendance ; en somme, une particule !
Tableau 1. Publications scientifiques de Richard Laming sur ses travaux sur l'électricité
|
Pour se rendre compte de la précocité des idées de Richard Laming, nous devrions souligner qu'à la fois l'électron n'était ni découvert ni même imaginé à l'époque et qu'aucun modèle atomique incluant des particules chargées électriquement n'était encore proposé, le modèle de Dalton étant encore basé à l'époque sur la notion de l'atome en tant qu'unité indivisible.
Laming imagina l'existence d'un nouveau type « d'atomes », qu'il a nommé electrical atoms, en anglais, tous de charge négative, interagissant entre eux par l'intermédiaire d'une force inversement proportionnelle au carré de leur distance – rappelons ici que la loi Coulomb avait déjà été formulée quelques décennies auparavant ; elle impliquait des corps portant une certaine « quantité d'électricité » sans pour autant en expliquer sa nature.
Il imagina également les atomes de base étant en « déficience » électrique et attirant les « atomes électriques », dans le but d'atteindre la neutralité. Le niveau de leur déficience, et donc le nombre « d'atomes électriques » nécessaires à leur neutralité, définirait le type d'atomes et donc de matière qu'ils puissent former. Selon Laming, les atomes électriques s'organiseraient en une sphère autour de l'atome. L'atome de son côté pourrait soit être complet et donc stable soit être incomplet et former des liaisons chimiques avec d'autres atomes de structure similaire. Ces liaisons pourraient alors se faire soit par échange soit par partage d'atomes électriques. Il est intéressant de noter que Laming imagina également la possibilité pour un atome électrique d'être forcé à sortir d'une sphère complète, résultant à un « état actif » de l'atome en question. C'est sans peine que nous reconnaissons dans cette description l'électron qui sera découvert un demi-siècle plus tard, la structure de l'atome proposée par Ernest Rutherford en 1911, les liaisons chimiques dont la liaison covalente introduite dans la théorie bien plus tardivement et même une vague idée de la radioactivité. Le point faible, suffisant pour enlever toute crédibilité voire même tout rôle historique aux idées de Laming fut qu'elles ne s'appuyèrent ni sur une formulation mathématique ni sur une démonstration expérimentale : elles semblèrent n'être que le fruit de son imagination.
Malgré l'accueil plutôt froid donc de ses idées par les scientifiques parisiens de l'époque, Richard Laming s'est vu offrir l'occasion de les démontrer expérimentalement devant un jury composé par pas moins que les physiciens Antoine Becquerel et Claude Pouillet ainsi que l'astronome Felix Savary, tous trois célèbres et reconnus par les institutions de l'époque. L'idée de l'expérience mise en place fut de démontrer que la masse d'un objet varie selon son état de charge et donc que la charge électrique a bien une nature matérielle. Dans ce cas, la théorie de Laming serait effectivement à même d'expliquer ce phénomène, contrairement à tout autre modèle formulé à cette époque. Malheureusement, il semblait évident à tous, y compris Laming, que les résultats de cette expérience dépendraient fortement de conditions externes allant de l'ajustement de l'appareil à la météo journalière.
Il semble peu probable que ces trois scientifiques eussent la moindre considération pour cette expérience non reproductible ou pour les théories de Richard Laming. À ma connaissance il n'y eu plus d'effort de démonstration par la suite, Richard Laming lui-même préférant la « démonstration » par l'expérience de la pensée plutôt que les méthodes scientifiques rigoureuses. Nous devons tout de même lui attribuer le mérite d'avoir, avec son « modèle atomique », fourni une réponse tout-à-fait satisfaisante à un casse-tête introduit par un article de Michael Faraday en 1844.
Figure 1. Portrait de Michael Faraday datant de 1842 Source : A painting of Michael Faraday from 1842 by Thomas Phillips, Wikimedia |
Dans cet article, Faraday argumente que si la matière est constituée d'atomes, ces derniers doivent être séparés par un espace vide. La conductivité du vide était alors inconnue, cependant la logique voulait qu'il fût soit conducteur soit isolant. Acceptant la première hypothèse, il fut impossible à Faraday d'imaginer comment certains matériaux puissent ne pas conduire l'électricité et inversement. La théorie de Richard Laming offrit une solution très élégante à ce casse-tête, supposant que les isolants consistent en des atomes ayant une couche externe « parfaite » à l'opposé des conducteurs dont la couche externe n'est qu'incomplète. Dans ce dernier cas, les électrons pourraient circuler plus ou moins aisément entre atomes « incomplets » et globalement d'un pôle d'une batterie à l'autre. Nous ne savons pas comment Michael Faraday a réagi à la lecture de cet article ou s'il l'a commenté, lui qui a basé toute son argumentation sur une méthode rigoureuse incluant l'expérimentation scientifique.
Richard Laming vivait dans cette ambiance mélancolique créée par l'indifférence générale pour ses travaux, quand il trouva, au début des années 1840, un soutien aussi inespéré qu'impressionnant en la personne du grand naturaliste Étienne Geoffroy Saint-Hilaire. Membre de l'académie des sciences, récompensé par la croix de la Légion d'honneur par Napoléon Ier et professeur de zoologie à la faculté des sciences de Paris et au Muséum national d'histoire naturelle, il suivit avec intérêt, prit sous son aile et encouragea les recherches de Richard Laming. Il parait étonnant que ce scientifique brillant eût été intéressé par ces théories nouvelles, hors de son domaine de recherche. Étienne Geoffroy Saint-Hilaire était cependant un scientifique audacieux, n'hésitant pas à défendre ses idées, il vit probablement se refléter sur son plus jeune collègue son propre désir de révolutionner et unifier les sciences, ainsi que de contrer un discours scientifique peut-être un peu trop rigide à ses yeux. À cette époque-là cependant, sa santé et sa vue avaient déjà décliné et il se retira de sa vie professionnelle quelques années plus tard, sans que son estime pour Laming puisse se traduire en un support et une aide significatifs.
Les autres sujets d'intérêts de Laming
Que ce soit par un sentiment de déception ou par une fébrilité d'esprit qui le poussa au changement, Laming se tourna peu après vers la chimie industrielle et plus précisément celle du charbon et du gaz de houille. Il rencontra dans ce domaine bien plus de succès et de reconnaissance, avec notamment plusieurs brevets à son nom, dont certains qui furent de grande importance pour le développement de ce type d'industrie. Il joua également un rôle dans le développement du télégraphe, auquel il apporta des améliorations non négligeables.
Richard Laming n'ayant pas été un scientifique, si nous commençons ce récit avec lui c'est qu'il fût réellement intriguant par son imagination, sa curiosité naturelle et sa vie intellectuellement aventureuse. Cependant, nous avons conscience que ne s'appuyant ni sur la démonstration expérimentale ni sur le calcul mathématique, il ne joua sûrement pas un rôle important dans l'histoire de l'électricité. En plus de la beauté de son histoire, il reste intéressant de voir l'opposition profonde entre sa démarche et celle qui sera décrite par la suite.
Ce n'était pas un hasard si Richard Laming montra un tel intérêt pour la nature de l'électricité. La curiosité humaine a toujours été tournée vers ses manifestations impressionnantes et souvent effrayantes depuis plusieurs centenaires voire millénaires avant notre ère. Son nom même, « électricité » témoigne des études entreprises par les Grecs de l'époque antique, autour de l'électricité statique générée suite au frottement d'un morceau d'ambre (ήλεκτρο en grec ancien). Avançons pourtant dans le temps jusqu'au 18e siècle, même si de nombreux travaux ont été entrepris auparavant et qui sans aucun doute contribuèrent aux découvertes qui démarrèrent en ce siècle. À cette époque, l'électricité était imaginée collectivement comme un fluide. La nature de ce fluide n'était pas bien comprise, ni les mécanismes par lesquels il circulait et agissait. Pour d'uns il existait deux sortes de fluide électrique de charge opposée, dits vitreux et résineux, tandis que pour d'autres ce fluide était unique et les deux comportements étaient dus à quelque chose évoquant vaguement des états de pression différents.
Les premières expériences pour comprendre la nature de l'électricité : du cerf-volant de Benjamin Franklin aux premiers condensateurs et piles
Nous pouvons, de manière plus ou moins arbitraire, démarrer cette histoire avec l'étonnante figure de Benjamin Franklin, qui s'intéressa fortement aux sciences et notamment aux effets électriques, et qui était partisan de cette deuxième théorie. Avec ses travaux sur l'électricité, il reste dans l'histoire autant pour l'importance de ses conclusions que pour l'incarnation de l'esprit scientifique. Il eut avec Richard Laming ceci en commun : ne résistant plus à l'appel de ses passions, il prit une retraite bien précoce de son activité professionnelle d'imprimeur, pour se consacrer pleinement à la science.
Figure 2. Portrait de Benjamin Franklin datant de 1778 Source : A painting of Benjamin Franklin from 1778 by Joseph-Siffred Duplessis, Wikimedia |
Bien que très impliqué dans la vie politique tumultueuse de l'époque, il mena une vie de chercheur ininterrompue. Son expérience audacieuse qui démontra la nature électrique de la foudre est sans doute la plus célèbre, mais ne résume en rien la totalité de ses contributions à l'avancement de cette science. L'histoire veut que Benjamin Franklin, intrigué par l'électricité et convaincu qu'elle se trouve cachée dans la nature des éclairs, proposa une expérience insolite. Il suggéra de faire voler un cerf-volant dans une nuit d'orage, après lui avoir attaché une clef métallique. Ainsi, le 15 juin 1752, près de chez lui à Philadelphie et par un temps orageux, son cerf-volant aurait attrapé la foudre et le câble aurait conduit la haute tension jusqu'à sa clef, provoquant une étincelle aussi jolie qu'effrayante. Benjamin Franklin n'a sûrement jamais réellement effectué cette expérience, il reste toutefois connu comme l'homme qui affronta l'orage par passion et curiosité.
Au sujet de l'expérience du cerf-volant de Franklin
On pourra consulter l'article : Le cerf-volant de Benjamin Franklin, un canard ? de Kamil Fadel.
De telles expériences étaient nombreuses à cette époque, Benjamin Franklin n'étant pas seul à s'enquérir sur l'électricité ni à pousser les limites de la raison. Suite à l'affront de Franklin face à l'électricité naturelle, une terrible machine permit, dans les années 1740, aux plus téméraires de se confronter à une forte décharge électrique créée artificiellement. Au début, il s'agissait d'un simple tube de verre contenant de l'eau et posé sur un plateau isolant. L'idée fut de démontrer qu'il est possible d'électrifier l'eau en y plongeant une tige métallique reliée à une source d'électricité. Petit à petit ce simple tube se transforma en ce qu'on appela plus tard « bouteille de Leyde », mais les aventures commencèrent bien avant.
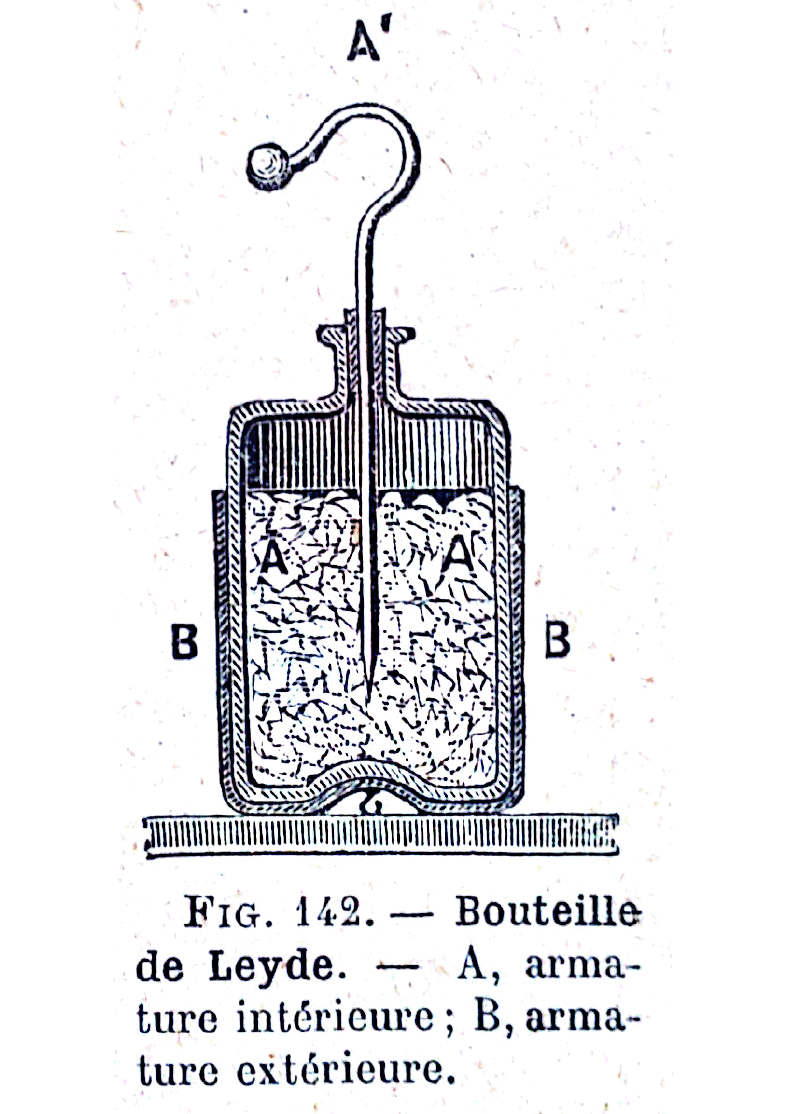
En 1745, le pasteur Prusse Ewald Jurgen Georg von Kleist eut l'idée d'enfermer dans une bouteille en verre de l'eau électrifiée – vue probablement comme de l'eau dans laquelle circulait le fluide électrique. Il remplit donc la bouteille et y plongea un clou qu'il électrisa à l'aide de sa propre machine électrique. Tenant toujours le verre à la main, il lui arriva, sans arrière-pensée, de toucher le clou également ; il ressentit alors une forte commotion, sa main et la bouteille fonctionnant comme les deux armatures d'un condensateur. Impressionné, il communiqua cette découverte aux membres de la communauté scientifique, à Berlin notamment, qui se précipitèrent pour reproduire l'expérience et publièrent la description de ces effets dès l'année suivante. Ewald von Kleist a probablement été l'inventeur de ce qui deviendra plus tard un condensateur, mais ne connut pas de considération particulière et son nom fut peu mentionné par la suite.
À la même époque, le physicien Pieter van Musschenbroek, qui lui était professeur à l'université de Leyde, produisit, probablement indépendamment de ces évènements, une version plus raffinée du même appareil en enveloppant la bouteille dans une couche de métal conducteur, séparé par la paroi en verre d'un deuxième conducteur constitué de feuilles d'étain chiffonnées et placées à l'intérieur. Nous savons maintenant que les deux faces stockent une quantité de charges égale mais de signe opposé, d'où la décharge violente en cas de contact. Cependant à l'époque cet effet constitua une énigme. Telle était l'intrigue qu'elle causait que les témoignages supplémentaires, très impressionnants voire effrayants, de van Musschenbroek, non seulement ne découragèrent ses collègues, mais les essais se multiplièrent, que ce soit pour des raisons scientifiques ou même de simple divertissement.
Figure 3. Coupe d'une bouteille de Leyde Source Yodah06, Wikimedia |
Dans un article de l'historien des sciences Jean Torlais nous trouvons une petite anthologie de témoignages. Van Musschenbroek lui-même tout d'abord, décrivant son expérience, dit : « La main n'est pas déplacée dans cette commotion, mais le bras et tout le corps sont affectés d'une manière terrible que je ne puis exprimer. En un mot, je crois que c'en était fait de moi… »
Le professeur Johann Heinrich Winckler raconte : « Je reçus, un jour, un terrible coup, en empoignant avec les deux mains deux fioles pendues à un canon de fusil. Ce coup était si énorme que j'en fus étourdi comme si on m'avait donné́ un grand coup sur le crâne et je ne me suis pas avisé de répéter l'expérience ! »
Le professeur Johann Heinrich Winckler parle ensuite de saignement du nez, de fièvre et de convulsions. Le physicien Jean Nicolas Sébastien Allamand, également à Leyde à ce moment, renchérit : « Vous ressentirez un coup prodigieux qui frappe tout votre corps. C'est un coup de foudre. », rappelant ainsi la bravoure de Franklin affrontant ce phénomène naturel.
L'interprétation de ce phénomène posait des difficultés considérables, d'autant plus que l'image de l'électricité en tant que fluide était très ancrée dans la conscience scientifique de l'époque. Benjamin Franklin tenta une explication basée sur l'idée d'« un plein de feu électrique » d'un côté et d'un « vide de feu électrique » de l'autre, séparés par du verre qui serait, lui, imperméable à ce feu. Les deux mis en contact, par la main du scientifique ou du curieux, quelque chose s'apparentant à une différence de pression résulterait de ce mouvement soudain du « liquide électrique ». L'explication de Franklin peut nous paraitre relativement proche de la réalité, si l'on remplace notamment les notions du vide et du plein par la notion de charges positives et négatives, mais ne suffisait pas à satisfaire l'auteur de ces propos lui-même. Il manquait encore à l'époque une compréhension plus profonde de l'essence même de l'électricité, qui ne viendra que plus d'un siècle plus tard.
Un pas de plus vers l'électron avec l'aide des « rayons cathodiques »
Cette aventure de la connaissance connut son apogée autour du mystère des rayons cathodiques. Le début de ce chapitre sembla pourtant tout à fait anodin. Dans un esprit similaire que lors des expériences passées, le physicien Michael Faraday, un des personnages clés, lui aussi, de l'histoire de l'électricité, fit passer, en 1838, un courant électrique à travers un tube de verre contenant de l'air relativement raréfié. Il constata alors quelque chose s'apparentant à un arc lumineux entre la cathode et l'anode lorsque la tension entre les deux était forte. Cette lumière inattendue intrigua les scientifiques qui se mirent à l'investiguer de manière passionnée.
Nous savons maintenant que cette lumière est le résultat de la désexcitation des atomes du gaz, précédemment excités par les électrons qui y circulaient, mais rien de tout cela n'était connu à l'époque. Le phénomène devint bien plus clair et facile à étudier dans les années 1860 et 1870 avec le développement des instruments utilisés. Utilisant de l'air plus significativement raréfié notamment, il devint clair qu'un « faisceau » de nature inconnue est émis par la cathode, voyage sans rencontrer d'obstacles en direction de l'anode, et émet un scintillement une fois en contact avec le verre à l'autre extrémité du tube. Il fut également constaté que l'anode elle-même provoque une « ombre » dans ce scintillement, comme si elle interrompait le trajet de ce mystérieux faisceau. Encore une fois tout ceci est facilement interprétable par nos contemporains et nous-mêmes, comme le passage aisé des électrons à travers de l'air raréfié et leur arrivée sur la paroi du tube pour exciter ses atomes.
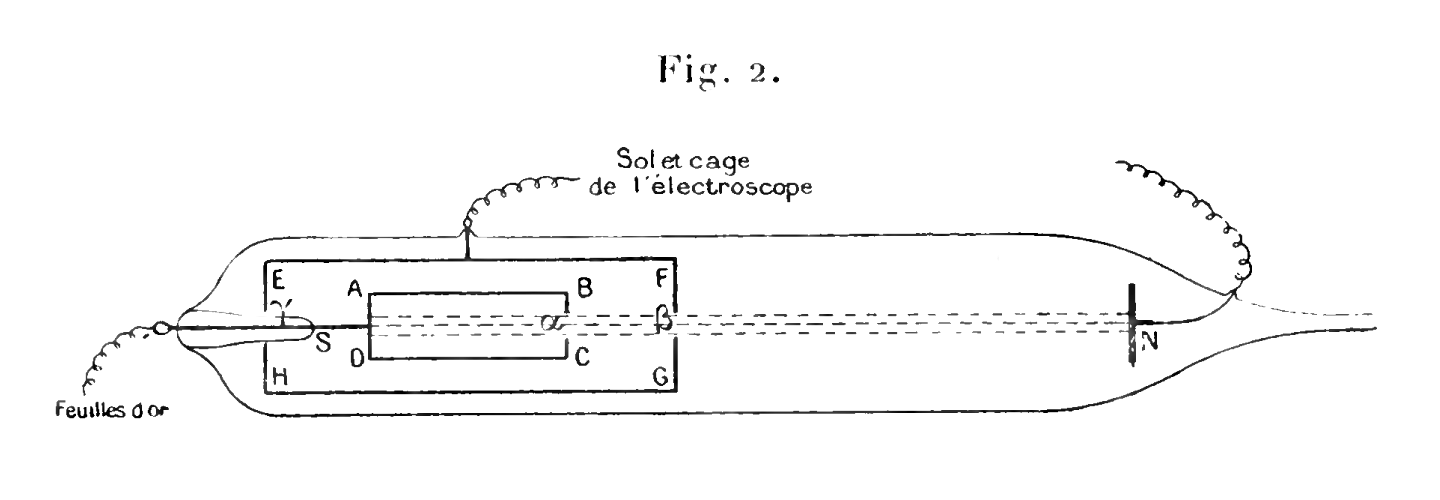
À l'époque les esprits s'emballèrent rapidement suite à ces expériences, le faisceau inconnu fut nommé « rayons cathodiques », les instruments commencèrent à évoluer dans le but d'une étude plus poussée, et déjà deux écoles se formèrent : ceux qui voyaient dans ces rayons les mêmes ondes électromagnétiques dont est faite la lumière, et ceux qui croyaient, ou espéraient, qu'il s'agisse là d'un faisceau de particules. Parmi les défenseurs de la théorie corpusculaire se trouvèrent deux personnes qui jouèrent un rôle très important dans l'évolution de cette histoire. La première était Jean Perrin, à l'époque jeune chercheur en thèse de doctorat à l'École Normale Supérieure. Son doctorat, consacré à l'étude des rayons cathodiques, fut le premier indice fort en faveur de la théorie corpusculaire. Perrin arriva à démontrer que ces rayons sont toujours accompagnés d'une charge négative, « ce qui est difficilement conciliable avec la théorie des ondulations, mais très en accord au contraire avec celle d'une émission », comme il expliqua à la conclusion de sa thèse, soutenue en 1897. Il utilisa pour ceci un tube à air raréfié avec une anode et une cathode, et il laissa les célèbres rayons cathodiques circuler jusqu'au cylindre ABCD qu'ils électrifièrent, figure 4.
Source : Par Jean Baptiste Perrin (1870-1942) — PhD Thesis of Jean Baptiste Perrin, University of Paris, France, imprimatur, may 12, 1897, Domaine public, Wikimedia |
Ensuite Perrin montra qu'en déviant ces rayons avec un champs magnétique, de manière à ne plus arriver à l'intérieur du cylindre, ABCD restait neutre. De plus, en inversant l'anode et la cathode il put mesurer l'effet inverse. Nous pouvons imaginer que la lecture de cette thèse ne fut pas agréable à certains de ses collègues, cet argument n'était cependant pas suffisant pour convaincre, ou en tout cas pour interrompre toute objection de la part des défenseurs de la théorie ondulatoire, comme le reconnut l'auteur lui-même. En effet, il écrivit dans sa thèse, deux ans plus tard : « Ceci n'était cependant pas une preuve de la théorie corpusculaire et ce pour deux raisons. Premièrement, il n'y avait nulle part d'évidence de quelque chose de discret. Deuxièmement, même si cette objection est plus difficile à accepter, le fait que les rayons cathodiques sont toujours accompagnés par une charge, ceci n'est pas une preuve qu'elles sont chargées en elles-mêmes ». Le jeune Jean Perrin ne fut donc pas associé à la découverte de l'électron, mais l'histoire eut, par la suite, plus d'une raison pour souligner son ingéniosité, sa passion et son dévouement en tout ce qui lui tenait à cœur.
La deuxième personne à avoir joué un rôle crucial dans la découverte de l'électron est Joseph John Thomson, professeur de physique au laboratoire Cavendish de l'université de Cambridge. C'est évidemment possible que le renom de ce professeur ait contribué à faire de son expérience une preuve cruciale de la nature corpusculaire de l'électricité, bien que la série d'expériences qu'il a mené a objectivement permis une compréhension profonde des rayons cathodiques et ne laissèrent plus de doute quant à leur nature. Pour appuyer cette affirmation, il vaut la peine de décrire à la fois son dispositif expérimental et les résultats qu'il produisit. Il faut également souligner que, comme tout expérimentateur, Thomson ne démarra pas son expérience sans idée apriori. Il croyait fermement que les rayons cathodiques sont composés de corpuscules chargés électriquement, comme l'a montré l'expérience de Jean Perrin, mais également identiques entre eux, ayant donc la même masse et la même charge. Nous pouvons supposer que la construction même de son expérience est basée sur cette conviction.
Rappelons aussi que Thomson, tout en entreprenant ses expériences, se rendait parfaitement compte de la difficulté de sa tâche. Il l'avoue lui-même au tout début de l'article qui en a résulté, nommé sobrement « cathode rays » : il explique que même si en apparence il ne doit pas être difficile de discriminer une onde d'une particule chargée électriquement, l'expérience passée démontre que des résultats expérimentaux de grande qualité peuvent nous mener dans les deux directions. Il faut peut-être ajouter que la difficulté de cette entreprise n'est que renforcée par les positions bien rangées des deux camps adverses. Il fallait donc, pour convaincre, que des preuves au-delà de tout doute soient fournies, non pas pour que la théorie défendue soit approuvée, mais plutôt pour que la théorie mise à l'épreuve soit définitivement abandonnée. Thomson explique que dans le cas des expériences de Perrin, fournissant bien la preuve que « quelque chose » de négativement chargé et sensible au champ magnétique, « quelque chose » donc d'absolument pas en adéquation avec la théorie ondulatoire, circule dans le tube, il reste improuvable qu'il s'agisse-là des rayons cathodiques en eux-mêmes. Thomson utilise la métaphore d'un tir de fusil qui provoque simultanément un flash de lumière ainsi que le lancement d'une balle, sans que la nature du flash et celle de la balle tirée puissent être confondues. Cette résistance aux arguments de Perrin peut paraître exagérée, Thomson comprit cependant qu'il ne devait laisser aucune place à des objections similaires.
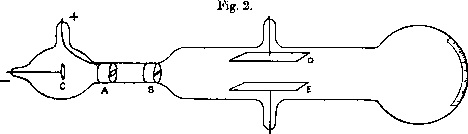
Joseph Thomson prit donc possession dudit « tube de Crooks », inventé en 1875 par le physicien William Crooks. Il s'agit là d'un tube hermétique contenant de l'air raréfié, à une pression bien plus faible que tous ses prédécesseurs. À l'une de ses extrémités se trouvent une anode et une cathode, face à face, avec une très haute tension entre les deux, ce qui crée les rayons cathodiques que Thomson vise à étudier. L'anode possède une petite ouverture, ce qui permet aux rayons cathodiques de traverser le tube et d'arriver jusqu'à son autre extrémité, générant ainsi la lumière fluorescente qui a motivé ses recherches. Voyageant en ligne droite, les rayons arriveront en plein milieu de la paroi du tube, si par contre ils subissent une déviation, un simple réticule suffit pour la repérer et l'estimer.
Figure 5. Tube de Crookes modifié par Joseph John THomson Source : Par Joseph John Thomson — Philosophical Magazine, 44, 293 (1897), Wikimedia |
Dans un premier temps, Thomson rajoute dans l'espace entre l'anode et l'extrémité du tube ou la fluorescence est provoquée, une paire de plaques métalliques dans le but de provoquer un champ magnétique perpendiculaire à la trajectoire des rayons. Il constata, sans surprise, que les rayons cathodiques sont déviés dans la même direction. Ceci n'était pas une surprise suite aux expériences de Perrin, mais Thomson jugea cependant utile et important d'appuyer les résultats et l'interprétation de son jeune collègue.
Thomson poursuivit scrupuleusement ses expériences. Dans un deuxième temps, il utilisa un champ électrique, toujours perpendiculaire à l'itinéraire des rayons mais également perpendiculaire au champ magnétique précédent. Il constata avec satisfaction que dans cette configuration les rayons sont déviés dans la même direction que lors de sa première expérience. Le sens de la déviation dépend du signe de la tension entre les plaques, mais dans tous les cas les rayons sont déviés vers la plaque qui est chargée positivement. Cet effet, en accord avec la théorie corpusculaire et jamais observé plus tôt, lui donna la possibilité d'utiliser les deux champs simultanément et de trouver un point d'équilibre pour lequel la force électrique et la force magnétique sont de valeur égale et de signe opposé et les rayons ne sont pas déviés. Calculant les déviations théoriques causées par un champ électrique et un champ magnétique et les égalisant, Thomson arrive à calculer à la fois la vitesse des rayons cathodiques et leur rapport de charge sur masse. Les deux résultats sont cruciaux pour ce qui va suivre. Tout d'abord, la vitesse calculée est bien inférieure à la vitesse de la lumière qui devrait être celle des rayons cathodiques, si assimilés à des ondes électromagnétiques. Cette différence était telle que ce fut probablement là le coup de grâce à la théorie ondulatoire.
De plus, le rapport charge sur masse était bien supérieur à toute autre valeur déjà calculée pour une particule connue - elle était de trois ordres de grandeur supérieure à celle d'un ion d'hydrogène, la plus petite entité connue à cette époque. Un rapport tellement important pourrait bien sûr être dû à une charge importante et non pas une masse faible, Thomson en est conscient. Il argumente dans un premier lieu que le parcours moyen traversé par des corpuscules démontre leur petitesse, mais préfère surtout une argumentation plus holistique et plus révolutionnaire, dans le souhait d'aller jusqu'au bout de sa réflexion par rapport aux rayons cathodiques. Il utilise pour cela un résultat tout aussi impressionnant de son expérimentation : ce rapport était stable, peu importe la nature du métal de la cathode ou du gaz contenu dans le tube. Les rayons cathodiques ne dépendent donc ni du matériau qui les émet ni du milieu qu'ils parcourent : elles ont une entité en elles-mêmes. Cette stabilité montre donc l'existence d'une particule, particule contenue dans les atomes de tous les éléments invariablement, et qui constitue les rayons cathodiques. Suivant ce cheminement logique, Thomson aurait donc découvert une nouvelle brique de la matière, un niveau en dessous de l'atome connu à l'époque. Il utilisa pour le designer le mot encore vague de corpuscule, mais il sera ensuite nommé « électron », appellation introduite par le physicien Irlandais George Stoney qui avait mesuré sa charge bien des années plus tôt n'ayant pas encore conscience de ce qu'elle représentait, et suggérée par un autre physicien Irlandais, George Fitzgerald.
Dès que Thomson eut conscience de ce qu'il a découvert, l'image de l'atome changea dans son esprit et son nom devint obsolète. Thomson découpa mentalement l'atome et l'imagina comme un ensemble d'électrons évoluant à l'intérieur d'une substance électriquement positive, de nature encore inconnue. Par un excès d'imagination ou de gourmandise, ce modèle se nomma par la suite modèle du « plum pudding ». Puis, la réfutation de ce modèle viendra d'un des étudiants de Thomson, lors d'une expérience passionnante : la fameuse expérience de Rutherford, qui montra que l'atome est principalement vide, avec une importante concentration de masse en son milieu, représentant le noyau atomique, et une certaine quantité d'électrons lui tournoyant autour.
Ceci n'était cependant que provisoire : notre vision de l'atome, ainsi que des particules élémentaires comme l'électron, devait changer pendant les premières décennies du siècle suivant. C'en est là une autre histoire, tout aussi intéressante, mais nous pouvons considérer que la première brique pour la construction de la théorie atomique fut tout de même la découverte de l'électron, non pas par un homme seul, mais par une suite ininterrompue de recherches réalisées par une multitude de scientifiques passionnés.
Références
[1] Richard Laming and the coal-gas industry, with his views on the structure of matter, W.V. Farrar B.Sc. Ph.D. (1969), Annals of Science, 25:3, 243-253.
[2] Thèses présentées à la Faculté des sciences de Paris pour obtenir le grade de docteur ès-sciences physiques, Jean Perrin, Paris, Gauthier-Villars, 1897.
[3] Cathode Rays, J. J. Thomson M.A. F.R.S. (1897), The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 44:269, 293-316.
Pour citer cet article :
Des fluides vitreux et résineux à l'électron : l'histoire d'une particule, Koletsou, juillet 2024. CultureSciences Physique - ISSN 2554-876X, https://culturesciencesphysique.ens-lyon.fr/ressource/histoire-electron-Koletsou.xml