Activer le mode zen
Ressource au format PDF
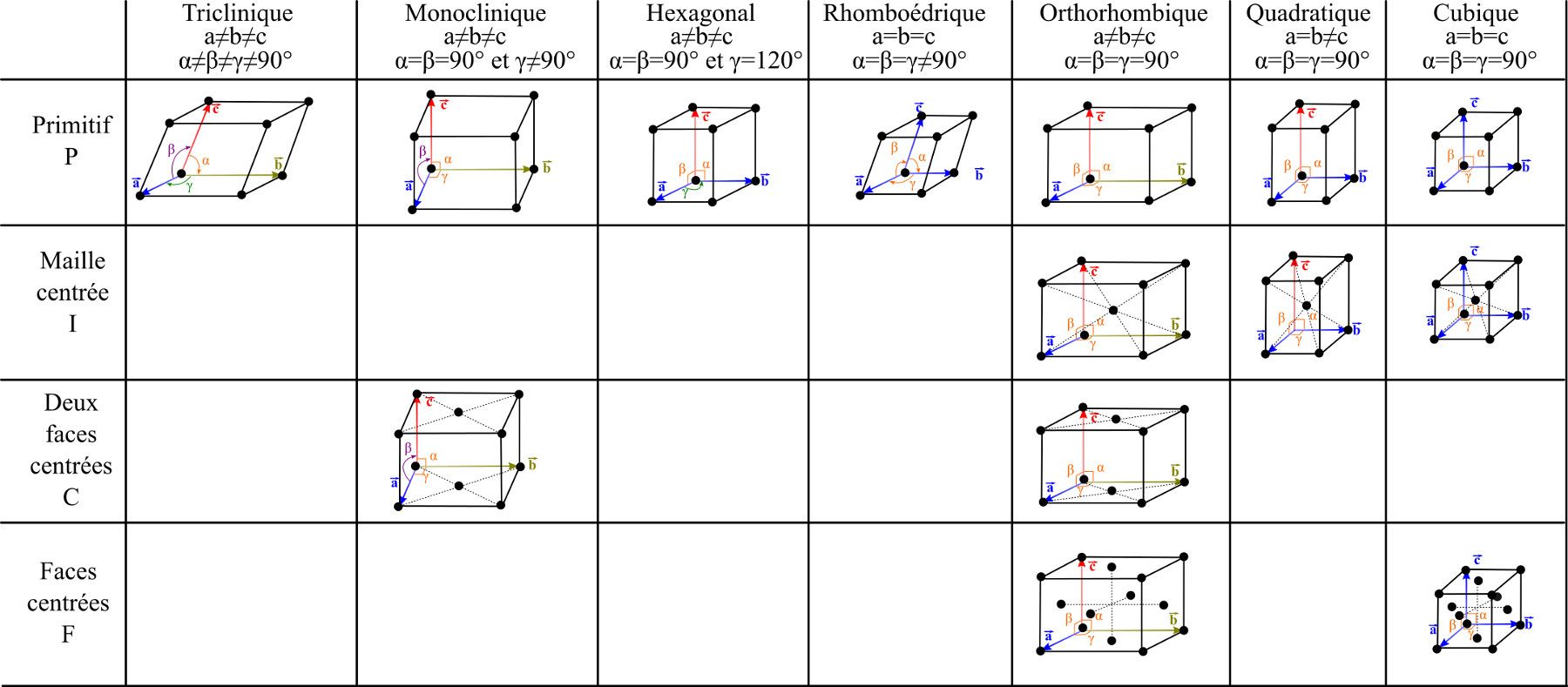
Classification
Des structures cristallines dans les organismes biologiques
04/01/2021
Résumé
Cet article commence par des rappels sur les termes “cristal” et “minéral”. L'auteur présente ensuite la production de minéraux variés par les êtres vivants : mécanismes chimiques et biologiques, recherche de biosignatures et de nouveaux matériaux bio-inspirés.
Table des matières
Un article pluridisciplinaire
L'édition de cet article a été coordonné par P. Combemorel (responsable éditorial du site Planet-Vie) qui est entré en contact avec l'auteur. K. Benzerara a accepté une relecture multiple relevant des points de vue de quatre disciplines (au sens universitaire : biologie, chimie, physique, sciences de la Terre) et l'intégration de compléments ou précisions permettant un accès à un public élargi. Cet article est donc proposé sur les 4 sites experts associés : CultureSciences-Physique, CultureSciences-Chimie, Planet-Vie etPlanet-Terre.
1. Introduction et définitions
L'idée que le vivant forme des cristaux peut sembler étonnante au premier abord. Ceci découle peut-être d'un réflexe consistant à associer les notions de cristal et de minéral à celles d'inanimé et de matière inorganique, tout en les opposant à celles de vivant, d'animé et de matière organique. Trois règnes ont d'ailleurs été longtemps distingués : minéral, végétal et animal. De plus, le monde académique cloisonne généralement l'étude du vivant et celle des cristaux. En effet, la cristallographie, enseignée sous l'angle de la physique ou de la géologie, reste vue comme une discipline à part de la biologie. Et pourtant… Il existe de nombreux cristaux formés par le vivant et qui sont importants dans le fonctionnement de la géosphère.
Reprécisons dans un premier temps certains termes. Il n'y a que peu d'ambigüité sur la notion de cristal. Un cristal est le plus souvent un solide, dont les atomes ou molécules constitutifs sont arrangés de manière très régulière dans l'espace. Les atomes et molécules sont disposés sur des plans, espacés de distances définies en se recoupant selon des angles bien précis. Par exemple, l'or (Au) ou le chlorure de sodium (NaCl) cristallisent sous la forme d'un réseau cubique à faces centrées…
Source - © 2017 Natan Capobianco et Gauthier Roisine / CSChimie
Figure 1. Réseaux de Bravais
Nous sommes entourés de cristaux au quotidien : citons les cristaux de quartz composant le sable de nombreuses plages, le diamant d'une bague, le graphite d'une pointe de crayon, les cristaux de semi-conducteurs dans toute l'électronique, ou encore, moins classiquement, un cristal de protéines (ou d'ADN) synthétisé au laboratoire. C'est d'ailleurs la diffraction des rayons X, méthode d'étude cristallographique, qui a permis à Rosalind Franklin de prendre le cliché à l'origine de la découverte de la structure de l'ADN.
On peut aussi évoquer les cristaux liquides dont les premières observations ont été réalisées par des biologistes et botanistes étudiant de la myéline ou du blé, en solution, à l'aide de microscopes polarisants[1].
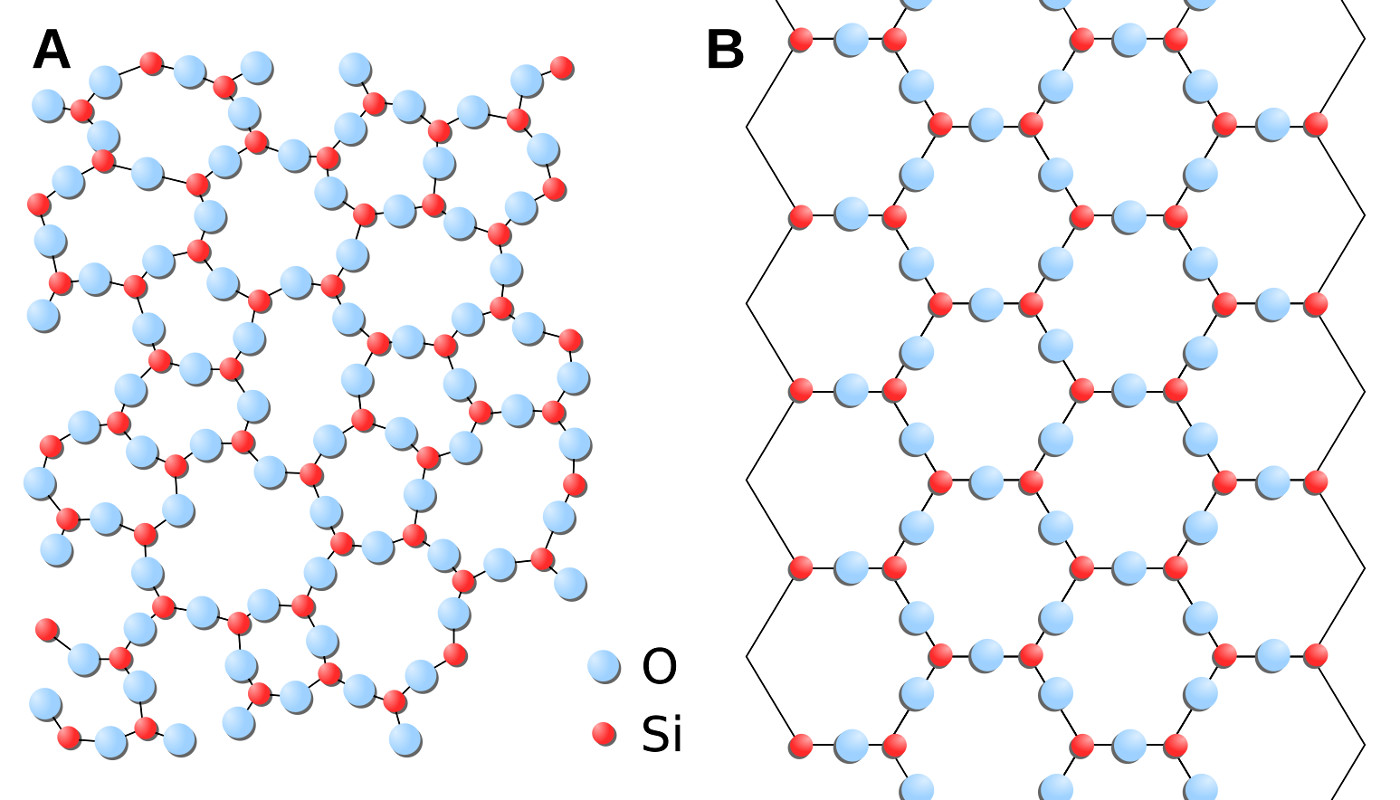
L'état cristallin s'oppose à l'état amorphe (ou vitreux) qui caractérise un solide dans lequel les atomes ne présentent pas l'arrangement périodique évoqué ci-dessus. Le verre d'une fenêtre, le frustule[2] des diatomées ou encore le squelette (test) des radiolaires constituent des exemples d'états amorphes avec une composition chimique élémentaire (SiO2) identique en première approximation à celle d'un cristal de quartz. En réalité, on conçoit qu'il existe des états intermédiaires entre le cristal parfait et l'état entièrement amorphe : il s'agit des solides dans lesquels on peut trouver un arrangement localement périodique des atomes (à l'échelle de quelques nanomètres / micromètres) mais dont la périodicité se perd à plus grande échelle spatiale.
Figure 2. Frustule de diatomée du lac Pavin (Massif Central) Le frustule est composé de silice amorphe et montre une architecture très détaillée à l'échelle submicrométrique avec des pores de différentes tailles et morphologies, ordonnés très régulièrement. Image par microscopie électronique à balayage. | Figure 3. État amorphe et état cristallin A : distribution spatiale désordonnée des atomes de silicium et d'oxygène dans une phase amorphe de formule chimique SiO2. B : distribution spatiale ordonnée des atomes de silicium et d'oxygène dans le quartz, de formule chimique SiO2. |
Enfin, pour nous rendre la vie difficile, il existe des faux amis dans le langage courant. Citons par exemple, le cristal d'Arques ou de Baccara qui est en fait un verre (donc possédant un état amorphe) enrichi en plomb, ce qui augmente son indice de réfraction et le rend plus “lumineux”, mais cela reste anecdotique.
Le terme « minéral » est en revanche plus ambigu. Il est parfois employé, notamment par les chimistes, dans le sens d'un composé inorganique (comme dans « matière minérale »), en opposition à l'organique qui regroupe les composés formés de carbone réduit[3]. En revanche, pour un minéralogiste, le « minéral » est une façon abrégée de dire une « espèce minérale » et dans ce cas la définition est très stricte, édictée par l'Association internationale de minéralogie (IMA en anglais). Il s'agit d'un solide dont il existe au moins une occurrence dans la nature (une espèce minérale ne peut pas être uniquement synthétique) et qui se caractérise par une composition chimique et une structure cristalline données. Dans ce sens, un minéral (au sens du représentant d'une espèce minérale) est donc forcément cristallin. Toujours selon ce sens, les molécules constituant le minéral peuvent être inorganiques ou organiques. Il existe ainsi des espèces minérales composées de molécules organiques, comme la weddellite, minéral composé d'oxalate de calcium dihydraté, cristallisé dans le système tétragonal (appelé aussi quadratique). C'est le composant majeur de certains calculs rénaux. Pour finir, on comprend que si l'on a des solides plus ou moins bien cristallisés (autrement dit plus ou moins amorphes), on va parfois étendre cette notion de minéral (au sens du minéralogiste) à des composés qui ne sont pas forcément des cristaux parfaits ; c'est par exemple le cas des opales. Les minéraux formés par le vivant sont d'ailleurs souvent des composés mal cristallisés.
Cette difficulté des ambigüités sémantiques soulevée, nous pouvons maintenant explorer la diversité des cristaux, et éventuellement des minéraux peu cristallisés, formés par le vivant.
2. Diversité des minéraux du vivant
Comme mentionné précédemment, il existe une très grande diversité d'espèces minérales qui peuvent être synthétisées par le vivant. On les nomme « biominéraux ». En 2003, Weiner et Dove [8] en recensaient près de 58, mais cette liste était incomplète et des occurrences biogéniques de nombreuses autres espèces minérales ont été découvertes depuis et continueront de l'être. Une famille minérale particulièrement représentée dans le vivant est celle des carbonates, et en particulier le carbonate de calcium CaCO3. La calcite (réseau de Bravais rhomboédrique) constitue le test[4] des oursins et de tous les échinodermes[5], la coquille des Pecten[6] ou la carapace et les yeux composés des trilobites, une classe d'arthropodes éteints depuis la fin du Permien il y a 250 millions d'années.
Figure 4. Test de l'oursin Paracentrotus lividus A : Le test de l'oursin Paracentrotus lividus est composé de plusieurs plaques assemblées comme un puzzle. Chaque plaque diffracte comme un mono-cristal de calcite. B : Coupe transversale du test observée en microscopie électronique à balayage. Les cristaux de calcite apparaissent clairs. Ils sont agencés très régulièrement à l'échelle micrométrique au sein de la structure qui est parsemée de trous (en foncé). |
L'aragonite (réseau de Bravais orthorhombique) est le composant de nombreux coraux coloniaux, de la nacre des Lamellibranches[7], et des lentilles des yeux des chitons (polyplacophores[8]). Enfin, différentes espèces minérales hydratées de CaCO3 ou les carbonates d'autres éléments comme le magnésium (hydromagnésite) et le strontium (strontianite) ont été identifiés comme biominéraux chez certaines bactéries.
Les phosphates sont une autre famille importante parmi les biominéraux avec notamment l'hydroxyapatite (Ca5(PO4)3(OH), système cristallin hexagonal) qui est le principal composant des os et des dents des Vertébrés[9]. Toutes ces phases minérales peuvent être formées par le vivant, mais on en connait aussi des occurrences non biogéniques. Ceci suggère qu'il n'existe pas d'espèce minérale spécifique du vivant à part peut-être la hazénite (KNaMg2(PO4)2,14 H2O, système cristallin orthorhombique) que l'on n'a jusqu'ici décrite que dans un seul échantillon dans lequel elle est formée par des microorganismes, ce qui est bien peu tout de même pour tirer de grandes conclusions. En résumé, le vivant peut produire des minéraux qui peuvent aussi être formés en l'absence de vivant mais, nous le verrons, avec éventuellement des caractéristiques un peu différentes.
Quelle peut être l'utilité de produire des minéraux pour les êtres vivants ? Il faut avant tout rappeler qu'il est important de ne pas sombrer dans un adaptationnisme outrancier consistant à penser que tout a une fonction. Ainsi, une quantité considérable de minéraux formés par le vivant n'a vraisemblablement pas de fonction : ils ne sont que les produits secondaires et contingents d'une activité biologique. En revanche, de nombreux biominéraux présentent des fonctions avérées, de nature variée : le soutien pour la locomotion (exo- et endosquelettes), la protection des organismes (mécanique ou contre la déshydratation), le rôle de lentille pour la vision (œil composé de calcite chez les trilobites, d'aragonite chez les chitons), la détoxification (les cristaux d'oxalate de calcium dans les vacuoles de cellules végétales, qui sont également impliqués dans la défense contre les phytophages), la régulation du pH intracellulaire chez certaines bactéries (qui forment des carbonates de calcium intracellulaires), la perception de la direction des lignes du champ magnétique terrestre (voir ci-dessous)…
Source - © 2015 Campus France Figure 5. L'Aiguille creuse d'Étretat La formation de ces falaises de craie résulte principalement de l'accumulation de coccolithes, cristaux de calcite formés par des algues unicellulaires, les coccolithophoridés. Une échelle est suggérée par les bateaux. |
En plus d'être diversifiés, les biominéraux représentent des masses importantes à la surface de la Terre. C'est le cas, par exemple, de l'accumulation de biominéraux d'aragonite formant aujourd'hui les récifs coralliens de la Grande barrière ou bien les minéraux carbonatés d'origine microbienne qui formaient les grandes barrières récifales du Précambrien (composées par des stromatolites). C'est le cas encore des cristaux de calcite et d'aragonite se formant lors d'efflorescences planctoniques géantes dans des lacs ou des océans (épisodes dits de whiting), dont on observe la gigantesque étendue par satellite. Ces efflorescences sont des évènements spontanés résultant par exemple de l'augmentation de la disponibilité d'un nutriment autrement en conditions limitantes. Ainsi, les biominéraux, comme « briques » de formations sédimentaires ou comme réservoirs géochimiques de taille importante pour différents éléments (le calcium, le carbone, le phosphore, le silicium…), intéressent sédimentologues et géochimistes. Mais ils intéressent aussi de nombreux autres champs disciplinaires.
3. Diversité des disciplines scientifiques étudiant les biominéraux
Figure 6. Calcul rénal composé majoritairement, dans ce cas, de cristaux d'oxalate La taille des calculs rénaux peut être variable. Ici ce calcul mesure un demi-centimètre. |
En médecine, les biominéraux constitutifs du squelette sont par exemple étudiés afin de comprendre l'origine d'anomalies des propriétés mécaniques du squelette (par exemple la maladie des os de verre) ou pour la mise au point de nouveaux procédés de synthèse de prothèses (McKee, 2015 [5]). Les propriétés macroscopiques particulières de l'os peuvent être influencées par différents paramètres qu'il faut caractériser. On compte parmi ces paramètres la composition chimique et la structure des cristaux, les arrangements géométriques entre cristaux eux-mêmes et entre cristaux et molécules organiques. Il faut aussi comprendre quels mécanismes biologiques de synthèse et de dissolution des cristaux et quelles régulations sont impliqués dans la formation du squelette. Enfin, certains biominéraux sont impliqués dans des pathologies. Par exemple, les calculs rénaux, ou lithiases urinaires, correspondent à différentes phases minérales d'oxalate de calcium plus ou moins hydratées (whewellite, weddelite) et/ou de phases de phosphate de calcium (hydroxyapatite), ou de phosphate de magnésium et d'ammonium (struvite). La composition minéralogique de ces lithiases est l'un des critères utilisés pour les classer et diagnostiquer l'origine de ces calculs (Daudon, 2008 [3]).
En paléoclimatologie, les biominéraux, en plus d'être des réservoirs de carbone, constituent des registres fossiles renfermant diverses informations comme la température et la salinité des océans du passé. C'est le cas par exemple de la calcite des tests de Foraminifères[10] ou des coccolithes formés par les algues unicellulaires de l'ordre des Coccolithophorales (coccolithophoridés). L'agencement et la morphologie de ces biominéraux sont utilisés comme critères de reconnaissance des espèces, permettant de reconstituer les paléoassemblages écologiques, indicateurs des paléoconditions du milieu. La mesure de la composition isotopique de différents éléments au sein de ces calcites dont l'oxygène (exprimée sous la forme du δ18O), permet de retracer les paléotempératures (Meibom, 2015 [6]).
La formation de minéraux par le vivant est étudiée par les sciences de l'environnement dans le cadre du piégeage de polluants. En effet, une grande diversité de bactéries induit la précipitation de minéraux qui, dans certains cas, incorporent dans leur structure des éléments polluants en solution, ou bien les adsorbent à leur surface, les soustrayant ainsi de la phase aqueuse. Dans la grande diversité du vivant et notamment des bactéries et des archées, il existe une grande diversité de phases minérales, y compris des sulfures (comme la pyrite, disulfure de fer cristallisé dans un système cubique, ou la sphalérite, sulfure de zinc cristallisé dans un système cubique aussi), de nombreux oxydes ou oxyhydroxydes de fer. Ces phases peuvent piéger de nombreux métaux (chrome, plomb, arsenic, etc.). Ainsi, un certain nombre d'études visent à mieux comprendre ces processus de formation de biominéraux pour qu'ils soient utilisés dans des processus de piégeage de polluants (bioremédiation, Benzerara 2018 [2]).
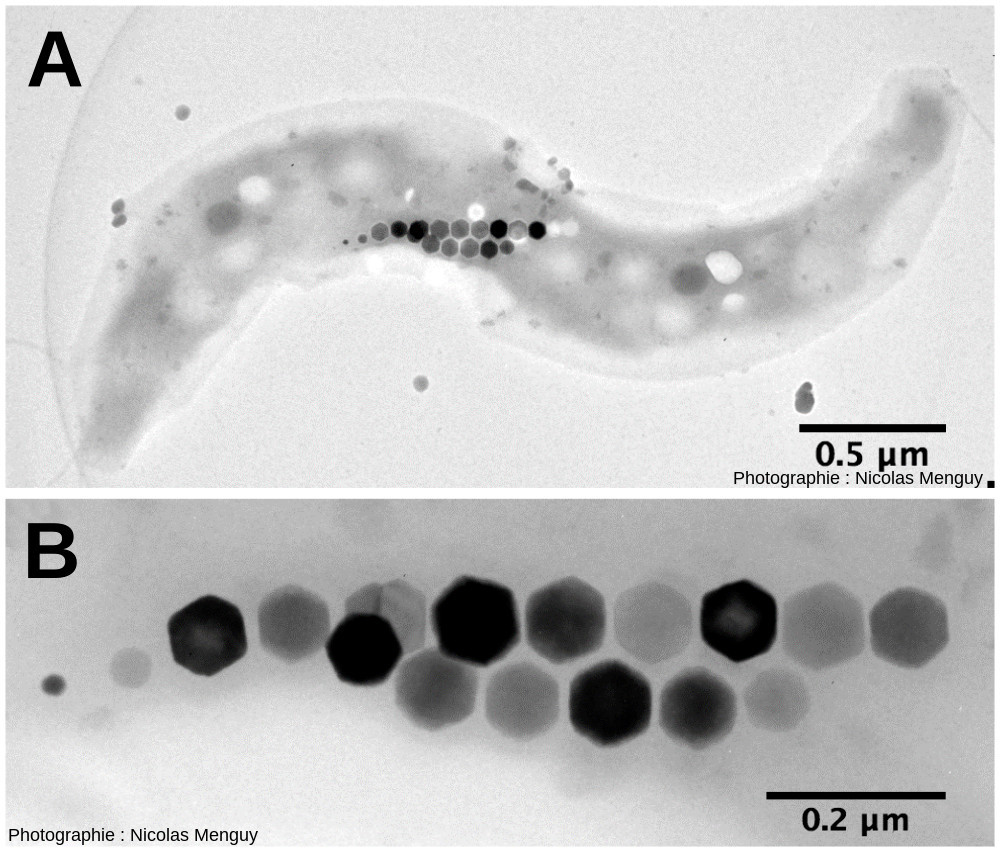
Figure 7. Bactérie magnétotactique Images de microscopie électronique en transmission d'une bactérie magnétotactique. La bactérie est un spirille. Une chaine de plusieurs cristaux de magnétite alignés apparait en sombre. L'agrandissement montre que ces cristaux de magnétite sous cette projection apparaissent comme hexagonaux. |
Les sciences des matériaux s'intéressent aussi de près à ces minéraux formés par le vivant car, si les espèces minérales concernées sont communes aux processus abiotiques, elles présentent des morphologies et propriétés physiques parfois très originales (Sanchez, 2016 [7]). Par exemple, certaines bactéries forment des cristaux intracellulaires de magnétite (un oxyde de fer) qui possèdent des propriétés magnétiques permettant à ces micro-organismes de percevoir la direction du champ magnétique et d'y répondre par un déplacement orienté (magnétotactisme). Ces propriétés magnétiques sont affectées par la taille des cristaux, leur cristallinité (c'est-à-dire le degré d'ordre structural des atomes évoqué au sujet des amorphes plus ou moins cristallisés), leur orientation et leur composition chimique. Ces bactéries contrôlent précisément ces paramètres et, au final, produisent des magnétites avec des propriétés magnétiques remarquables, difficiles à reproduire abiotiquement en laboratoire. Ainsi, les mécanismes que ces bactéries utilisent sont étudiés afin de pouvoir à terme reproduire ces cristaux à l'identique dans un contexte de bioinspiration. Il faut également noter que l'on retrouve aussi des cristaux de magnétite dans l'oreille interne d'oiseaux migrateurs, mais les mécanismes de la magnétoréception restent encore imparfaitement connus chez ces organismes.
Les exobiologistes[11] recherchent des caractéristiques qui pourraient être propres aux biominéraux, c'est-à-dire absentes des minéraux formés abiotiquement. De telles caractéristiques constitueraient alors des biosignatures qui permettraient la recherche de traces de vie extraterrestre, en particulier sur Mars. Il s'agit d'un enjeu majeur pour les différents robots instrumentés envoyés sur la surface de Mars comme Curiosity ou Perseverance. L'identification et la caractérisation des minéraux formés par le vivant est d'autant plus intéressante dans ce domaine de recherche que ces structures résistent généralement mieux au temps que les cellules ou molécules organiques. Il reste cependant un travail important à fournir et de nombreux débats à résoudre sur notre connaissance de ce qui est ou n'est pas une biosignature et comment cette dernière est modifiée par les processus se déroulant après la mort de l'organisme (Benzerara, 2006 [1]). Par exemple, il y a quelques années, des cristaux nanométriques de magnétite ont été retrouvés dans la météorite martienne ALH84001. Certains scientifiques ont souligné le fait que la relative pureté chimique et l'expression de faces particulières au niveau de ces cristaux étaient connues seulement dans les magnétites formées par les bactéries magnétotactiques terrestres et qu'ils y voyaient ainsi une biosignature. D'autres scientifiques ont cependant montré par la suite que la relative pureté chimique pouvait résulter de processus non biologiques et ont conclu que les faces particulières n'étaient pas particulièrement exprimées dans ces cristaux de magnétite. Ceci invalidant les arguments utilisés en premier lieu, la communauté scientifique a conclu que l'existence de traces de vie passées sur Mars restait à démontrer.
4. Les mécanismes de formation des minéraux par le vivant
Pour qu'un minéral se forme dans une solution, il faut que celle-ci soit sursaturée par rapport à cette phase minérale, c'est-à-dire que le produit des concentrations[12] des espèces chimiques, atomes ou molécules, constituant la phase minérale dépassent la solubilité de la phase minérale. Considérons par exemple l'équilibre de précipitation de la calcite à partir d'ions calcium Ca2+ et d'ions carbonates CO32− :
- Ca2+ + CO32− ⇌ CaCO3(s).
Pour que la calcite précipite, il faut que le produit de la concentration des ions Ca2+ et des ions carbonates CO32−, nommé produit ionique, dépasse la constante de solubilité Ks de la calcite qui dépend de la température.
Ks = [Ca2+]eq.[CO32−]eq, où l'indice eq indique les concentrations à l'équilibre. Il y a précipitation si [Ca2+].[CO32−] > Ks.
À noter aussi que la constante de solubilité est spécifique de la phase formée. Ainsi, la solubilité de l'aragonite est plus élevée que celle de la calcite à la surface de la Terre.
Si le produit ionique des ions impliqués dans la formation d'un minéral est inférieur à la constante de solubilité, la solution est dite sous-saturée : le minéral ne peut pas précipiter. En revanche, si le produit ionique est supérieur à Ks, la solution est sursaturée et le minéral peut précipiter. Cette condition thermodynamique n'est cependant pas suffisante pour que l'on observe effectivement la précipitation. En effet, la cinétique de la réaction peut être très lente et le minéral mettre des millions d'années à se former. Ceci peut être lié notamment à la barrière d'énergie (barrière d'activation) qu'il faut franchir pour aller des réactifs aux produits. Or la vitesse de la réaction peut être accélérée par une augmentation du produit ionique : plus la solution est sursaturée et plus la vitesse est importante jusqu'à un point où la réaction devient quasi-immédiate.
Ces principes permettent de comprendre l'un des modes d'action du vivant sur la formation des minéraux. Si l'on poursuit avec l'exemple de la calcite, tout processus conduisant à une augmentation locale de la concentration en Ca2+ et/ou de la concentration en CO32− augmente la saturation d'une solution par rapport à la calcite. Ainsi, une solution sous-saturée peut devenir sursaturée par rapport à la calcite ou bien si elle était déjà sursaturée avant l'action du vivant, la cinétique de précipitation de la calcite peut s'accélérer. La concentration en ions CO32− peut elle-même augmenter soit suite à l'augmentation de celle des ions bicarbonate (HCO3−) à pH constant, soit suite à l'augmentation du pH à concentration en ions bicarbonate constante. Plusieurs processus biologiques conduisent à une telle augmentation, au moins localement. Par exemple, la photosynthèse chez des organismes aquatiques, qu'il s'agisse de cyanobactéries ou d'algues unicellulaires, tend généralement à faire diminuer la concentration en CO2 autour des cellules :
- 6 CO2(g ou aq) + 6 H2O(g ou aq) ⇌ C6H12O6(s) + 6 O2(g).
Par conséquent, suivant la loi de Le Châtelier[13], cela tend à déplacer vers la droite l'équilibre de la réaction de précipitation des carbonates :
- 2 HCO3−(aq) + Ca2+(aq) ⇌ CaCO3(s) + CO2(g) + H2O(aq)..
C'est pourquoi de nombreux organismes aquatiques photosynthétiques peuvent induire la précipitation de phases minérales carbonatées. D'autres métabolismes peuvent produire le même effet comme l'uréolyse, c'est-à-dire l'hydrolyse de l'urée, catalysée par de nombreuses bactéries et qui induit une forte augmentation de pH. Pour des raisons semblables, ces mêmes métabolismes favorisent aussi la précipitation de phases minérales phosphatées. Cela se produit par exemple dans certaines infections urinaires par des klebsielles ou des staphylocoques qui entrainent alors la précipitation de minéraux, souvent des phases phosphatées, formant ainsi certains cas de lithiases urinaires. Enfin, il existe des cas de biominéralisation où le calcium est concentré par la cellule localement, par exemple dans un compartiment intracellulaire, via des transporteurs spécifiques, conduisant là encore à augmenter la saturation de la solution par rapport à une phase calcique. Un tel mécanisme a été démontré chez les coccolithophoridés et est postulé chez certaines bactéries « géantes » comme Achromatium oxaliferum et certaines cyanobactéries qui forment des carbonates de calcium intracellulaires.
Figure 8. Cellule de Gloeomargarita lithophora Image colorisée de microscopie électronique à balayage montrant une cellule de Gloeomargarita lithophora (en vert), une cyanobactérie formant des phases amorphes de carbonate de calcium intracellulaires (clair – jaune à rosé). Le filtre sur lequel a été récupérée la cellule est colorisé en bleu et les pores du filtre apparaissent en noir. |
Il existe une autre grande classe de processus utilisés par le vivant pour modifier/contrôler la formation des minéraux : il s'agit de la formation de matrices organiques qui interagissent avec la surface des minéraux en voie de formation, permettant ainsi d'isoler ces surfaces de la solution aqueuse environnante. Cette voie intervient notamment très fréquemment dans le contrôle de la formation extracellulaire de biominéraux. Ces matrices organiques permettent dans certains cas de stabiliser le minéral en croissance et de diminuer la barrière d'activation de la nucléation, l'étape initiale de la formation du cristal. Ainsi, la cinétique de précipitation du minéral peut être accélérée et ceci permet de localiser la formation du minéral sur les structures organiques impliquées. De plus, dans certains cas, la matrice organique oriente la direction de croissance des cristaux et permet un réel contrôle cristallographique des structures formées. Ces matrices organiques ont été abondamment retrouvées et décrites dans la coquille des mollusques par exemple. Elles sont composées d'une grande diversité de molécules, notamment de protéines qui peuvent modifier la nature du biominéral formé (avec par exemple une orientation de la cristallisation vers l'aragonite ou la calcite), sa forme et sa taille et l'orientation de ses axes cristallographiques. Ces principes sont à la base de la construction de structures aussi particulières que la nacre, qui revêt l'intérieur de certains Lamellibranches par exemple, et qui consiste en l'empilement très ordonné de tablettes d'aragonite avec des tailles très finement contrôlées. Il a de plus été montré que le mélange intime entre ces cristaux et quelques pourcents de matière organique confère aux coquilles une résistance mécanique sans équivalent avec celle d'une aragonite abiotique. De la même façon, la formation des os fait intervenir une matrice organique extracellulaire notamment riche en collagène. Ceci confère à nouveau une source d'inspiration (bioinspiration) de grande valeur pour le spécialiste des matériaux.
Source - © 2007 Yoruno - CC-BY-SA 3.0 Figure 9. Coquille d'ormeau (Haliotis tuberculata) vue de l'intérieur et de l'extérieur L'intérieur de la coquille est composé de nacre. Ces coquilles mesurent plusieurs centimètres de long. | Figure 10. Nacre de la coquille d'Haliotis tuberculata La nacre de la coquille d'Haliotis tuberculata, correspond à l'empilement très régulier de plaquettes d'aragonite. |
5. Cristaux et vivant, des entités intimement liées depuis les origines de la vie
L'étude des biominéraux requiert de caractériser leur structure atomique, leurs propriétés chimiques et physiques et fait ainsi appel au savoir-faire communément partagé en physique et chimie des matériaux ainsi qu'en minéralogie. Mais il faut adjoindre à ces approches l'étude des structures du vivant et de son fonctionnement, impliquant les contributions de la biochimie, de la biologie moléculaire (de nombreuses protéines, notamment des enzymes, et donc de nombreux gènes sont impliqués dans les processus de biominéralisation) ou de la biologie des organismes. La compréhension de l'importance de ces interactions entre le minéral et le vivant à de grandes échelles spatiales et temporelles doit faire intervenir la géochimie d'une part et la biologie de l'évolution d'autre part. Certaines de ces interactions ont été façonnées au cours de milliards d'années d'évolution, recrutant des innovations biomoléculaires que l'on est encore loin d'avoir inventoriées exhaustivement. Il a fallu vraisemblablement un certain temps avant que les animaux puissent disposer d'un ensemble complet de biomolécules et notamment de protéines leur permettant de construire un squelette. C'est à partir de ce moment que la faune a pu se fossiliser de manière bien plus importante (« explosion cambrienne »). Chez les quelques bactéries contrôlant la biominéralisation, on connait très mal encore la nature et la phylogénie des protéines impliquées qui auraient pu apparaitre très tôt dans l'histoire de la vie.
Récemment, un recensement des espèces minérales existant à la surface de la Terre a été replacé dans le cadre de l'histoire de notre planète. Il a été proposé que leur diversité a sensiblement augmenté au cours des 4,55 milliards d'années, notamment grâce à certains phénomènes biotiques (Hazen et Ferry, 2010 [4]). Ainsi, il y a 2,4 milliards d'années, lors de l'évènement de grande oxydation qui correspond à une augmentation drastique de la teneur atmosphérique en dioxygène produit par les cyanobactéries, le nombre d'espèces minérales aurait pu augmenter de près de 1500 à plus de 4000. Plus qu'une production d'espèces minérales spécifiques du vivant, il faut y voir la conséquence d'une modification des conditions physico-chimiques à la surface du globe (notamment de la pression partielle en dioxygène, pO2), induite par le vivant, et qui a transformé irréversiblement le fonctionnement de notre planète. Cette perspective, nommée « évolution minérale », ancre encore plus l'évolution des minéraux à celle de la vie. En retour, le rôle vital de certains minéraux pour le fonctionnement du vivant démontre qu'il semble aujourd'hui impossible de comprendre les histoires de la vie et de la Terre indépendamment l'une de l'autre.
Références
K. Benzerara. 2006. Mécanismes de biominéralisation et biosignatures minéralogiques, site de la Société française d'exobiologie
K. Benzerara, 2018. Un piège bactérien à strontium et baryum, “Zoom Science” sur le site de l'IMPMC
M. Daudon, O. Traxer, E. Lechevallier, C. Saussine, 2008. Épidémiologie des lithiases urinaires, Progrès en Urologie, 18, 12, 802-814
R.M. Hazen, J.M. Ferry, 2010. Mineral Evolution: Mineralogy in the Fourth Dimension, Elements, 6, 1, 9-12 [pdf]
M. McKee, 2014. Protein regulation of normal and pathologic mineralization, Biomineralization Short Courses, Labex MATISSE - CNRS (1h08min)
A. Meibom, 2014. Reconstructing paleo-environments (with corals), Biomineralization Short Courses, Labex MATISSE - CNRS (52min)
C. Sanchez, 2016. Micro-organismes : des usines à nanoparticules ?, conférence du Collège de France (1h18min)
S. Weiner, P.M. Dove, 2003. An Overview of Biomineralization Processes and the Problem of the Vital Effect, Reviews in Mineralogy and Geochemistry, 54, 1,1-29
[1] Voir par exemple cet article du Journal du CNRS : Tous les cristaux liquides sont dans la nature.
[2] Le frustule est une coque composée de deux valves emboîtées l'une dans l'autre (comme dans une boîte de camembert) et qui entoure la cellule des diatomées.
[3] On désigne par carbone réduit, un atome de carbone contenu dans des molécules où il a un nombre d'oxydation inférieur à 0. C'est le cas d'atomes de carbone liés à des atomes d'hydrogène notamment. Un carbone réduit est susceptible d'être transformé en carbone oxydé (comme le carbone du CO2) en libérant des électrons.
[4] Le mot « test » désigne l'enveloppe externe dure qui entoure certains organismes unicellulaires (Foraminifères, Coccolithophoridés, Radiolaires…) et pluricellulaires (Arthropodes, Mollusques…).
[5] Les Échinodermes sont des animaux marins à symétrie pentaradiaire : oursins, étoiles de mer, lys de mer…
[6] Le genre Pecten regroupe différentes espèces de coquilles Saint-Jacques.
[7] Les Lamellibranches, ou Bivalves, constituent un groupe de Mollusques caractérisé par la présence d'une coquille formée de deux valves et de branchies en lamelles (moules, huîtres…).
[8] Les Polyplacophores sont des Mollusques dont la coquille est constituée de huit plaques calcaires articulées entre elles.
[9] L'exposition Pierres précieuses au Muséum national d'histoire naturelle à Paris, qui sera ouverte jusqu'au 14 juin 2021, donne à voir plusieurs spécimens extrêmement beaux de minéraux précieux formés par le vivant.
[10] Les Foraminifères forment un groupe d'unicellulaires marins entourés par un test glycoprotéique auquel s'associe secondairement du calcaire, de la silice ou du matériel détritique aggloméré.
[11] L'exobiologie est la branche de la biologie qui s'intéresse aux conditions nécessaires à l'apparition de la vie, que ce soit sur Terre ou ailleurs dans l'Univers.
[12] En réalité non pas les concentrations mais les activités chimiques qui traduisent la disponibilité des espèces chimiques pour la réaction de précipitation, mais nous simplifions ici.
[13] L'une des formulations ce cette loi est « Un système thermodynamique en équilibre soumis à une perturbation (introduction d'un nouveau constituant, augmentation de la pression, variation de la température, etc…) tend à s'opposer à cette perturbation, le déplacement de l'équilibre tendant à restituer les conditions initiales. »
Pour citer cet article :
Des structures cristallines dans les organismes biologiques, Karim Benzerara, janvier 2021. CultureSciences Physique - ISSN 2554-876X, https://culturesciencesphysique.ens-lyon.fr/ressource/cristaux-biologie.xml