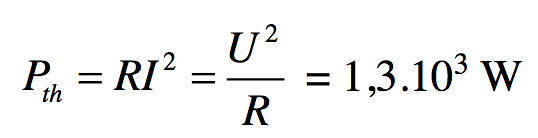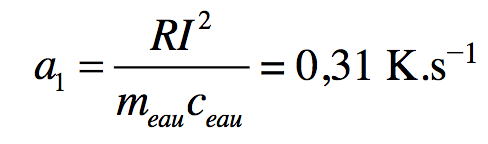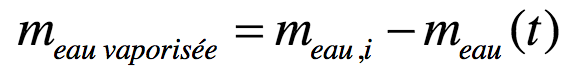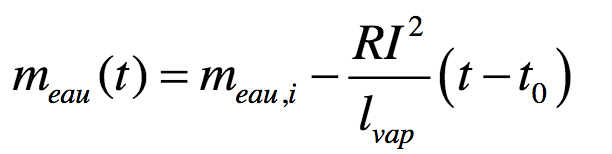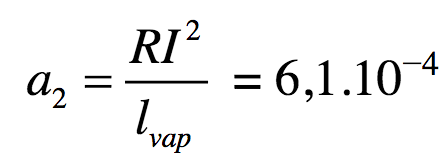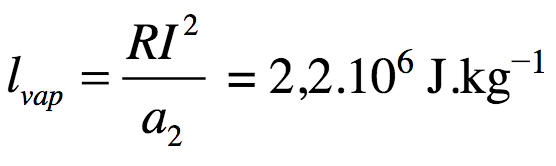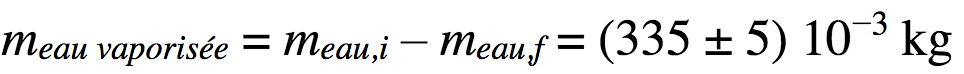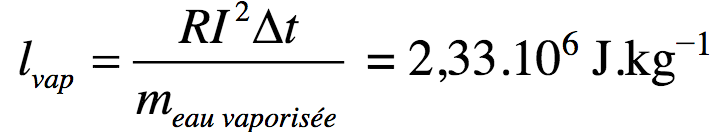Activer le mode zen
Ressource au format PDF
Mots-clés
- chaleur
- capacité thermique massique
- thermique
- changement d’étate
- évaporation
- Olympiades de physique
Classification
Détermination expérimentale de la capacité thermique massique et de l'enthalpie massique de vaporisation de l'eau
18/05/2020
Travail réalisé dans le cadre des XXVIIe Olympiades de Physique sous la tutelle de Benoît Depret, professeur de Physique-Chimie.
Résumé
Cet article propose de retrouver expérimentalement la capacité thermique massique et la chaleur latente de vaporisation de l’eau.
Table des matières
Introduction
De l’énergie thermique apportée à l’eau permet d’augmenter sa température ou d’effectuer la transition de phase liquide-vapeur (vaporisation). On se propose dans cet article de retrouver expérimentalement la capacité thermique massique et la chaleur latente massique de vaporisation (ou enthalpie massique de vaporisation) de l’eau pour mieux comprendre leurs effets.
1. Détermination expérimentale de la capacité thermique massique de l'eau
Définition de la capacité thermique massique
La capacité thermique massique à pression constante est la quantité d’énergie qu’il faut fournir à un kilogramme du corps considéré pour élever sa température de un degré K (ou °C), tout en maintenant sa pression constante. Cette énergie est emmagasinée dans les différents degrés de liberté internes accessibles aux atomes : mouvement brownien ou vibration des atomes ou molécules, rotation et vibration interne des molécules. Cette grandeur dépend a priori de la température et de la pression mais pour l’eau liquide, entre 0°C à 100°C et à la pression de 105 Pa, elle varie de moins de 1%.
On place une masse = 1,00 kg d’eau dans une bouilloire et on mesure à la fois la température de l’eau et la masse de l’ensemble au cours du temps, figure 1. la bouilloire reste ouverte tout au long de la manipulation. Un ventilateur permet en outre d'évacuer plus facilement la vapeur d'eau afin d'éviter que celle-ci ne se recondense dans le système. La laine de verre est placée autour de la bouilloire, mais pas au dessus, afin de limiter les pertes thermiques. La bouilloire dispose d’une résistance chauffante R = 40 Ω dissipant de l’énergie thermique par effet Joule. La puissance thermique moyenne dissipée vaut :
En prenant = 230 V la valeur efficace de la tension du secteur. Attention, on note tout de même que la tension du secteur n'est pas constamment égale à 230 V. Il existe des variations temporaires de ±10% sur la valeur efficace délivrée par le fournisseur d'électricité.
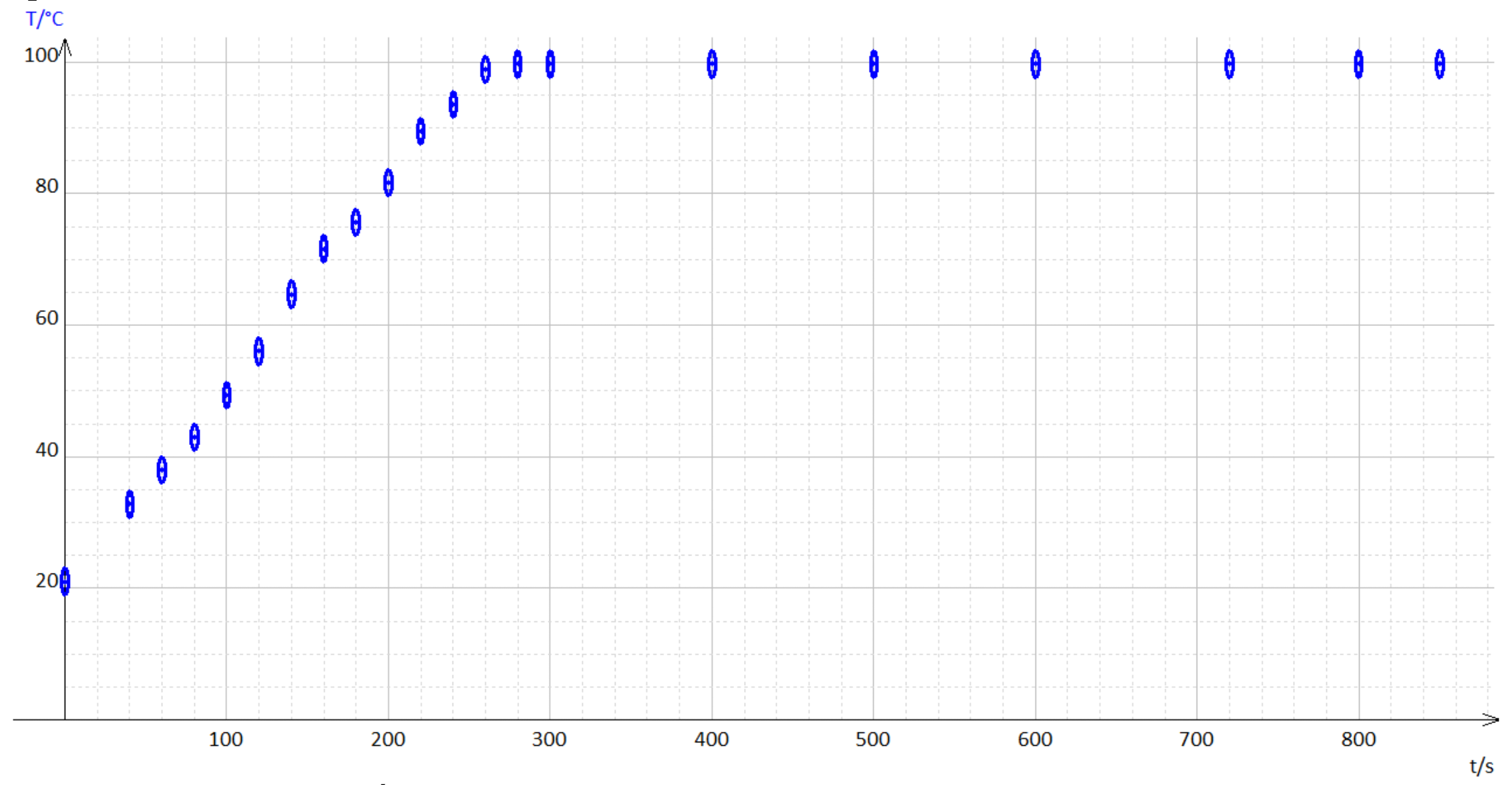
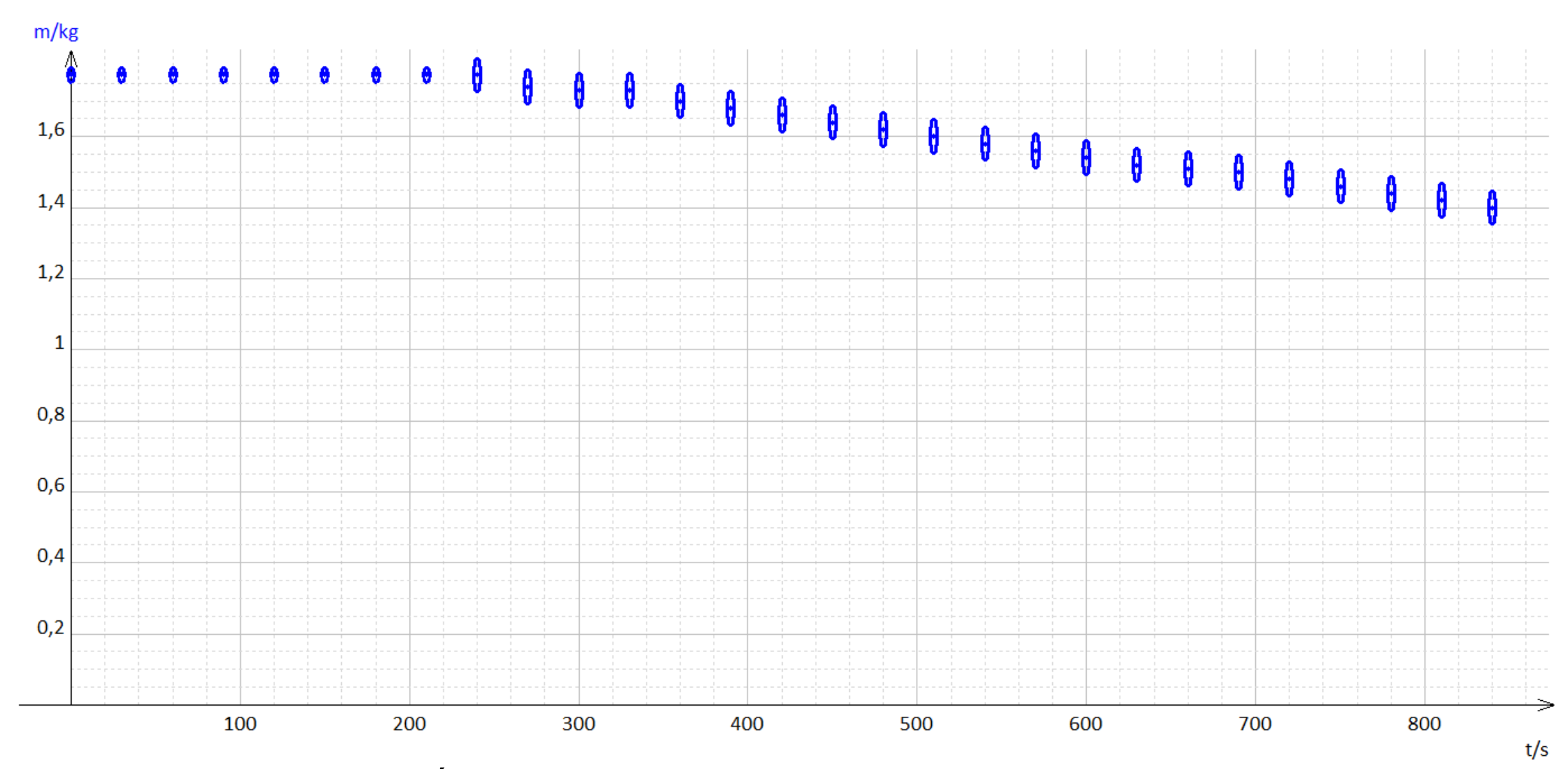
La température de l’eau augmente rapidement au cours du temps. Il faut bien mélanger l’eau dans la bouilloire pour homogénéiser la température. Pendant ce temps, la masse d’eau dans la bouilloire reste constante. À partir de 240 s, l’eau se met à bouillir. La température se stabilise alors au voisinage de 100°C, tandis que la masse d’eau dans la bouilloire diminue. Les remous dus à l’ébullition de l’eau font trembler la bouilloire sur la balance, ce qui rend plus difficile la mesure de la masse et tend à augmenter les incertitudes. Lors de l'expérience, il est alors nécessaire de scotcher soigneusement le fil d'alimentation.
On utilise un ventilateur qui permet d’évacuer la vapeur d’eau produite et éviter qu’elle ne se condense dans la bouilloire.
Finalement, ici, la bouilloire fait office de calorimètre bon marché.
Les évolutions de la température et de la masse de l’eau au cours du temps sont présentées sur les figures 2 et 3.
On suppose que les pertes thermiques vers l’extérieur peuvent être négligées. Durant la phase de chauffe, l’énergie thermique apportée par la résistance chauffante permet d’augmenter la température de l’eau. La conservation de l’énergie permet d’écrire :
où est la capacité thermique massique de l’eau. Dans ce modèle, la température de l’eau évolue de façon affine avec le temps :
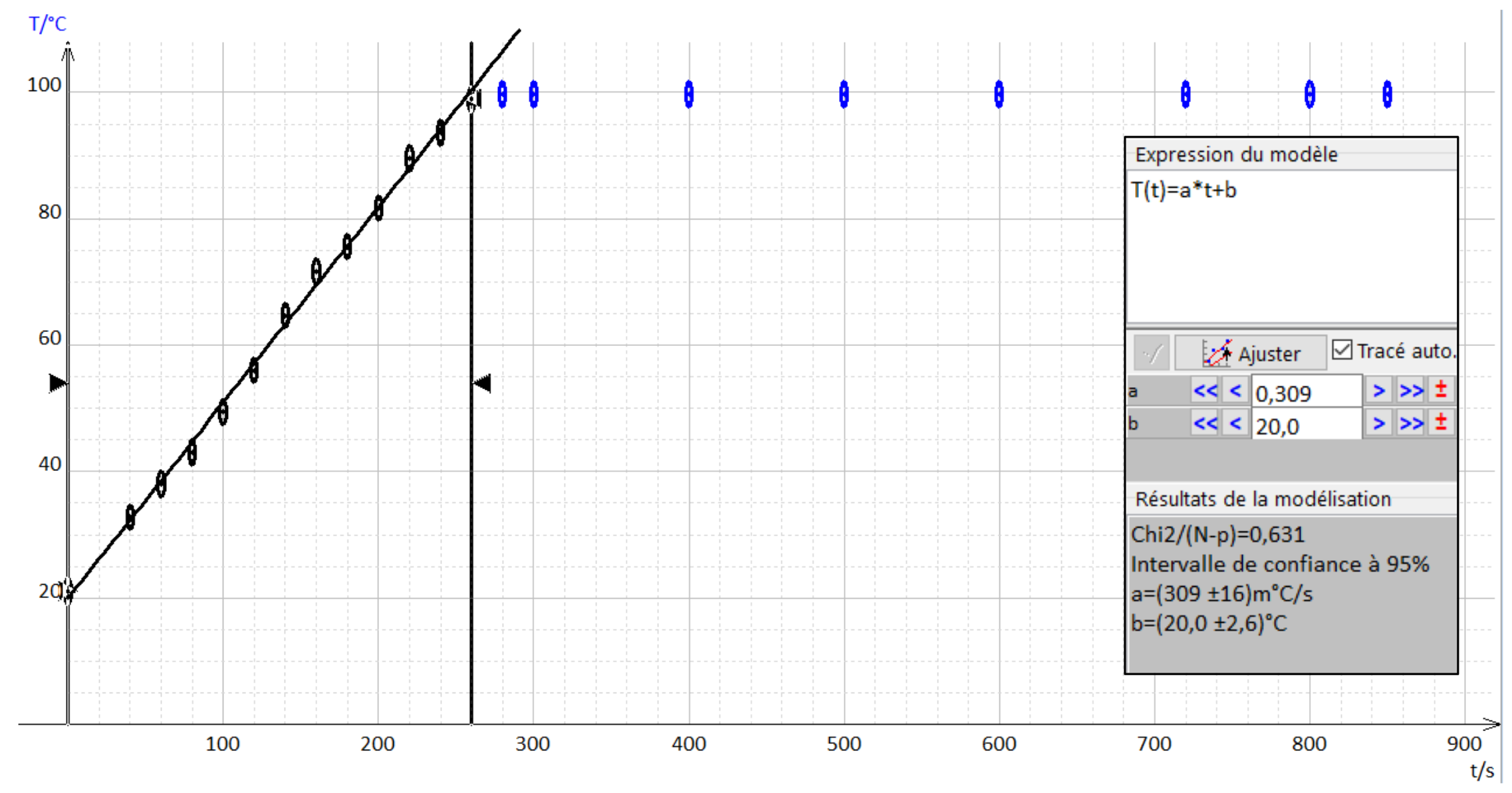
Ce résultat est bien en accord avec les points expérimentaux, figure 4.
Figure 4. Présentation des différentes situations |
Une régression linéaire pendant la phase de chauffe permet d’obtenir :
avec l’incertitude = 0,02 K.s-1
On en déduit :
avec l’incertitude relative : = 6,5%
La capacité thermique massique de l’eau déterminée expérimentalement est = 4,2 ± 0,3.103 J.kg-1K-1 |
On retrouve bien, aux incertitudes près, la valeur tabulée = 4,18.103 J.kg-1K-1
2. Détermination expérimentale de la chaleur latente massique de vaporisation ou enthalpie massique de vaporisation de l’eau
Définition de la chaleur latente massique de vaporisation ou enthalpie massique de vaporisation
La chaleur latente massique de vaporisation est la quantité d’énergie qu’il faut fournir à un kilogramme du corps considéré pour le faire passer de l’état liquide à l’état vapeur (gaz), sous une pression fixée. Dans une phase condensée, par des effets concurrents d’attraction (à longue distance) et de répulsion (à courte distance), il est énergétiquement plus favorable que les atomes ou molécules se placent dans un certain voisinage l’un de l’autre. L’énergie apportée permet alors aux atomes (ou molécules) de quitter cet état de proximité. Cette grandeur dépend également de la température et de la pression. Pour l’eau liquide, entre 0°C à 100°C et à la pression de 105 Pa, elle varie de 4%. On notera que l’évaporation ne se produit pas uniquement à l’ébullition. Sur tout le domaine où l’eau liquide existe, les phases liquide et vapeur coexistent, dans un état d’équilibre thermodynamique caractérisé notamment par la pression de vapeur saturante.
Durant la phase d’ébullition, l’énergie thermique apportée permet la vaporisation de l’eau sous la pression atmosphérique constante. La conservation de l’énergie s’écrit dans ce cas :
où est l’enthalpie massique de vaporisation de l’eau et t0 l’instant de début de l’ébullition. La masse d’eau vaporisée s’écrit en fonction de la masse d’eau initiale et de la masse d’eau restante :
Dans ce modèle, la masse d’eau dans la bouilloire varie de façon affine avec le temps :
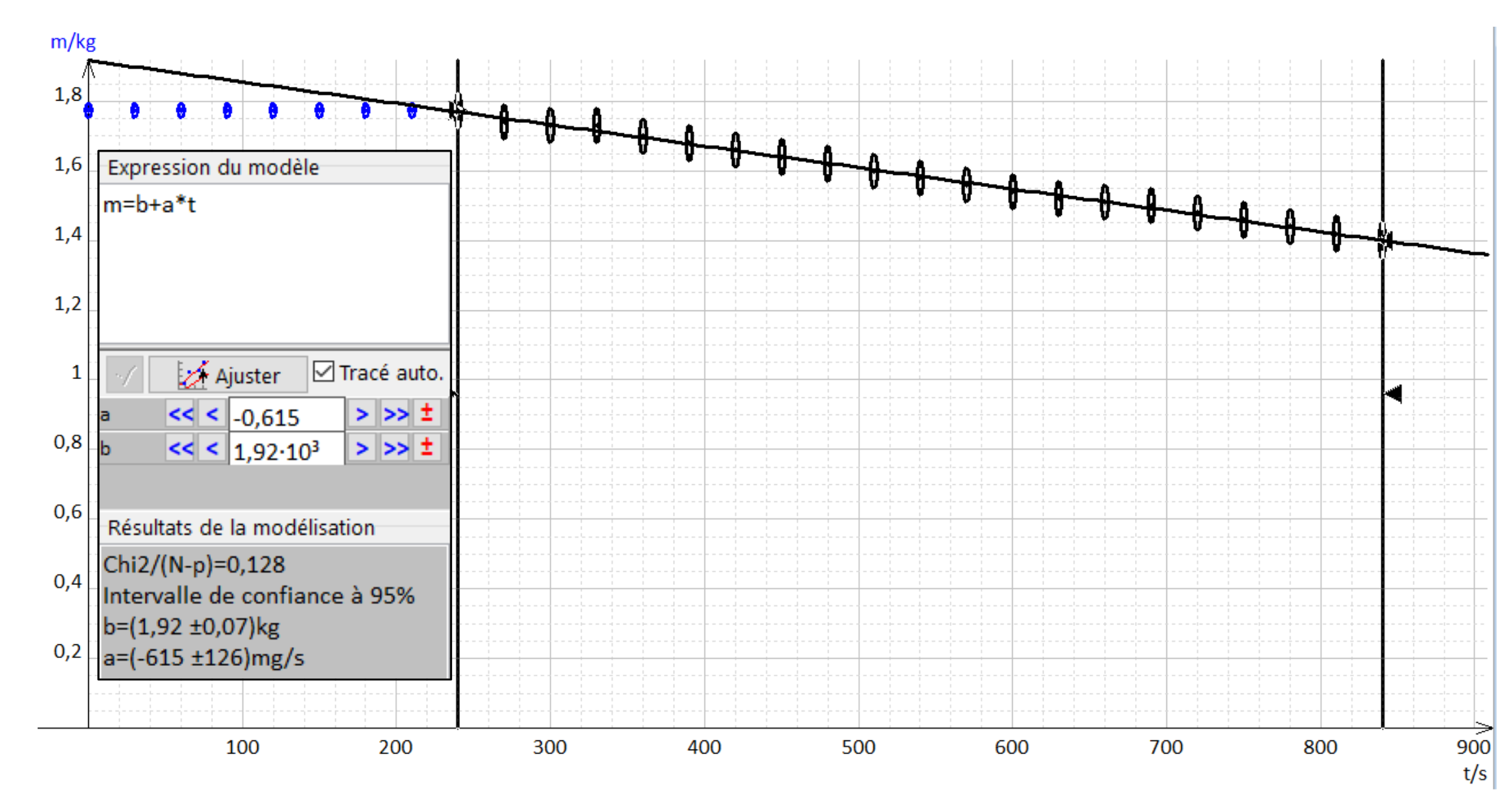
Ce résultat est à nouveau en accord avec les mesures expérimentales, figure 5.
Une régression linéaire pendant l’ébullition permet d’obtenir :
avec l’incertitude = 1,3.10-4 kg.s-1
On en déduit :
avec l’incertitude relative : = 21%
L'enthalpie massique de vaporisation de l’eau trouvée expérimentalement est = 2,2 ± 0,4.106 J.kg-1 |
La valeur tabulée de l'enthalpie massique de vaporisation vaut = 2,1.106 J.kg-1.
On retrouve expérimentalement la valeur tabulée aux incertitudes de mesure près. Celles-ci sont particulièrement importantes pour cette expérience à cause de la mesure de la masse à la balance au cours de l’ébullition.
Après = 600 s d’ébullition, on a arrêté la bouilloire et laissé l’eau se refroidir. On a alors mesuré la masse d’eau restante : = 665 ± 5.10-3kg.
La masse d’eau vaporisée pendant cette durée vaut donc :
On en déduit une autre mesure de l’enthalpie de vaporisation de l’eau
avec l’incertitude relative : = 1,5%
Pour citer cet article :
Détermination expérimentale de la capacité thermique massique et de l'enthalpie massique de vaporisation de l'eau, Trystan Marquilly, Enzo Putrino, mai 2020. CultureSciences Physique - ISSN 2554-876X, https://culturesciencesphysique.ens-lyon.fr/ressource/proprietes-eau.xml