Activer le mode zen
Ressource au format PDF
Mots-clés
- électrons
- électrons libres
- électrons de conduction
- conduction électrique
- couches électroniques
- métal
- liaison métallique
- gaz d'électrons libres
- cristal
- bande de valence
- bande de conduction
- pesanteur
- conduction
- interaction gravitationnelle
- interaction électromagnétique
- gravité
Classification
Des électrons vraiment libres ?
15/06/2007
Résumé
Quel est l'effet de la pesanteur sur les électrons libres dans un métal ?
Table des matières
Figure 1. Une bobine de fil de cuivre | Certains électrons sont libres à l'intérieur d'une pièce métallique. Pourquoi ne s'accumulent-ils pas vers le bas sous l'effet de la pesanteur ? |
D'après La physique en questions, Electricité et magnétisme, J.-M. Lévy-Leblond et A. Butoli, ed. Vuibert, 1983
Les forces en jeu
Un métal est en première approximation un édifice d'ions positifs ordonnés spatiallement dans un gaz d'électrons libres (modèle proposé par Drude en 1900). Chacun des électrons libres se déplace dans le métal sans être lié à un ion particulier. Ils ont un mouvement aléatoire, une agitation thermique avec une énergie cinétique de l'ordre de kT et subissent des interactions faibles avec les ions et les autres électrons. Ces électrons mobiles sont les électrons de conduction : lorsqu'un champ électrique est appliqué, leur lent déplacement d'ensemble sous l'action de la force électrique constitue le courant électrique, les interactions avec le réseau cristallin étant responsables de la résistivité électrique.
Nous pouvons estimer les forces d'interaction électrostatique et d'interaction gravitationnelle qui s'exercent entre un électron libre et un cation du réseau cristallin, par exemple Cu+.
Soit d la distance qui sépare l'électron de masse me et de charge électrique qe = -e d'un cation de masse mc et de charge électrique qc. La force d'interaction électrostatique attractive (loi de Coulomb) s'écrit :
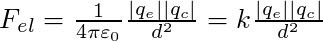
et la force d'interaction gravitationnelle, attractive également (loi de Newton) :
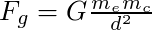
Le rapport de ces deux forces vaut : 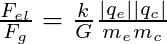 et ne dépend pas de la distance
électron-cation.
et ne dépend pas de la distance
électron-cation.
Dans le cas du cuivre, qui possède un électron libre par atome, on considère les interactions entre un électron et un cation Cu+ avec 63 nucléons (isotope le plus courant). Avec :
- k = 8,99 x 109 N.m2.C-2
- G = 6,67 x 10-11 N.m2.kg-2
- qe = - 1,60 x 10-19 C
- me = 9,11 x 10-31 kg
- mc = 63 x 1,67 x 10-27 kg (en considérant identiques les masses des protons et des nucléons)
on obtient Fel/Fg = 3,60 x 1037 ! La force d'interaction gravitationnelle électron-cation est complètement négligeable devant la force d'interaction électrostatique entre ces deux espèces chargées.
En considérant que la distance électron libre-cation est approximativement celle de la distance électron-noyau dans l'atome de cuivre isolé, c'est à dire en prenant pour d la valeur du rayon atomique soit 128 pm (d'après la classification périodique des éléments de la Faculty of Chemical Technology, University of Split,Croatia), on estime la valeur de Fel à 1,4 x 10-8 N.
Déplacement des électrons sous l'effet de la pesanteur
Calculons maintenant la force d'interaction gravitationnelle entre un électron libre et la Terre, c'est à dire le poids P d'un électron libre. En prenant g = 9,8 N.kg-1, g étant l'intensité de la pesanteur à la surface de la Terre, on trouve P = meg = 8,9 x 10-30 N, soit 6 x 10-22 fois moins que Fel.
Bien que très faible, le champ de gravitation agissant sur les électrons libres (et également sur les ions du réseau) modifie (très légèrement) l'organisation d'un solide metallique. Sous l'effet de la pesanteur, le réseau ionique se « tasse » légèrement et les électrons libres se déplacent « vers le bas ». Ce faisant, il se crée des champs électriques induits qui s'opposent aux forces de pesanteur et les compensent. J.-M. Lévy-Leblond et A. Butoli expliquent qu'en faisant l'hypothèse d'un réseau ionique inaffecté, "il suffit pour les électrons de « tomber » de 10-32 m environ pour être retenus par les ions...".
Considérons une tranche de métal d'épaisseur Z0, contenant ne électrons libres par unité de volume, soumis à leur poids qui les entraîne vers le bas. Il se crée une accumulation de charges négatives près de la surface inférieure de la tranche, sur une épaisseur e, et un déficit de charges sur la surface supérieure (accumulation de charges positives). Cette épaisseur e est une bonne estimation de la hauteur de chute des électrons libres soumis à la pesanteur. La tranche de métal peut être considérée comme un condensateur plan, entre les armatures duquel se crée un champ électrique induit qui vaut E = qe ne e / ε0. La force électrique induite subie par les électrons s'oppose alors au poids : Fe = qe E = P = meg. Cette égalité permet d'obtenir une expression de l'épaisseur e : e = ε0meg/(qe)2 ne. Pour le cuivre, dont le nombre d'électrons libres par unité de volume vaut ne = 8,5 x 1028 m-3, on calcule e = 3,6 x 10-32 m.
On peut comparer ce déplacement à la distance interatomique, de l'ordre de 10-10 m, ou au libre parcours moyen d'un électron de conduction accéléré sous l'effet d'un champ électrique appliqué au métal : dans du cuivre, à température ambiante, ℓ ~ 3 x 10-8 m. C'est la distance typique parcourue par un électron libre entre deux « collisions » avec des impuretés, des défauts cristallins ou des phonons (mouvements ondulatoires des ions du réseau). On voit que les ordres de grandeurs sont bien différents et que l'effet de la pesanteur est très faible.
Qu'est-ce qu'un électron libre dans un métal ?
Le modèle classique des métaux
Modèle classique de la structure de l'atome : Un atome est constitué d'un noyau contenant Z protons chargés positivement (pour un élément de numéro atomique Z) autour duquel gravitent Z électrons, de charge négative. Ce système noyau-électrons est décrit comme un système de planètes gravitant autour d'une étoile : les électrons sont répartis sur des orbites sphériques concentriques autour du noyau qui forme le centre de l'atome. Le noyau exerce une force d'interaction électrostatique attractive sur chacun des électrons, inversement proportionnelle au carré de la distance r noyau-électron. Plus l'électron est éloigné du noyau, moins la force est grande.
Un métal solide est un édifice cristallin, un réseau ordonné d'atomes. Les atomes forment des structures tridimentionnelles, des mailles, qui se répètent telles un motif. Les atomes sont proches les uns des autres : les distances interatomiques sont de l'ordre de 10-10 m, tout à fait comparables au rayon atomique. Les électrons, tout particulièrement les plus périphériques, sont soumis à des interactions supplémentaires de la part des noyaux situés à proximité et de leur cortège électronique. Pour certains des électrons périphériques, ces interactions avec les autres noyaux sont si fortes qu'ils sont libérés de leur atome initial : ce sont les électrons libres ou électrons de conduction. Ils circulent de proche en proche dans l'ensemble du solide sous l'effet des champs électromagnétiques générés par les autres espèces chargées. Leur distribution dépend du potentiel électrostatique créé par les noyaux et les électrons liés.
L'apport de la mécanique quantique : un spectre de bandes
En ce qui concerne la structure de l'atome, la mécanique quantique ne localise pas les électrons sur des orbites, mais indique des régions de probabilité de présence des électrons : les orbitales atomiques. Chaque électron peut être caractérisé par son niveau énergétique moyen. Ces niveaux énergétiques sont quantifiés, et dépendent de 4 nombres quantiques appelés n, l, m, et s qui ne prennent que des valeurs entières. Le nombre quantique n caractérise la couche électronique à laquelle appartient l'électron et l'usage veut que les couches soient repérées par les lettres K, L, M, N... Plus n est élevé, plus l'électron a une énergie moyenne grande, et plus il se « situe » loin du noyau. Le principe d'exclusion de Pauli fixe la manière dont les Z électrons se répartissent entre ces différentes couches électroniques : deux électrons ne peuvent avoir les 4 mêmes nombres quantiques, de sorte que la couche K (n=0) contient au plus 2 électrons, la couche L (n=1) en contient 8 et la couche M (n=2), 18. Les couches se remplissent en partant d'abord de la couche interne la plus proche du noyau. La couche la plus éloignée est le plus souvent incomplète : c'est la couche de valence.
Les atomes métalliques conducteurs de l'électricité possèdent au moins un ou deux électrons de valence, peu liés au noyau et situés en périphérie de l'atome. Dans le métal, ces électrons sont mis en commun par les atomes. L'énergie des électrons et les orbitales atomiques sont modifiées par les interactions avec les autres atomes. Pour l'atome, le spectre en énergie des électrons est constitué de niveaux. Au fur et à mesure que l'on rapproche les atomes les uns des autres lors de la constitution du cristal, les interactions entre niveaux démultiplient chacun des niveaux du spectre initial en un grand nombre de niveaux très proches les uns des autres, formant un spectre dit "de bandes". Le principe d'exclusion de Pauli reste valable, et les électrons remplissent les différents niveaux autorisés par ordre croissant d'énergie. Dans l'état fondamental (à la température T = 0 K), le niveau le plus élevé atteint est appelé niveau de Fermi. La bande totalement remplie la plus élevée en énergie porte le nom de bande de valence. La bande autorisée située juste au-dessus d'elle s'appelle la bande de conduction. Elle est séparée de la bande de valence par une bande interdite. Pour les métaux, le niveau de Fermi est situé à l'intérieur de la bande de conduction, qui est donc déjà partiellement remplie dans l'état fondamental. Ces électrons situés dans la bande de conduction ont une liberté de mouvement : ce sont les électrons libres. Lorsque la température augmente, leur niveau énergétique augmente, mais ils ne changent pas de bande d'énergie, donc leur nombre (souvent 1 par atome comme pour le cuivre) ne varie pas.
Pour citer cet article :
Des électrons vraiment libres ?, Catherine Simand, juin 2007. CultureSciences Physique - ISSN 2554-876X, https://culturesciencesphysique.ens-lyon.fr/ressource/QSelectronslibresSol.xml




