Activer le mode zen
Ressource au format PDF
Mots-clés
énergie énergétique thermodynamique énergie mécanique chaleur calorimétrie machine à vapeur conservation de l'énergie entropie premier principe deuxième principeClassification
I - L'élaboration du concept d'énergie
12/01/2009
Résumé
Exposé historique de l'élaboration du concept d'énergie. Première partie du dossier « Les multiples visages de l'énergie », proposé par Roger Balian (première publication le 31 août 2002).
Article suivant : « II - Conséquences énergétiques des principes fondamentaux »
Table des matières
Cet exposé introductif a pour but de mettre en évidence l'éclairage apporté par la physique sur les questions énergétiques. En deux siècles, l'énergie a envahi notre vie quotidienne, facilitant les transports, l'industrie, le chauffage ou les multiples usages domestiques de l'électricité. Les problèmes économiques, sanitaires, géopolitiques, technologiques qu'elle pose font la une des journaux. Pourtant, le discours sur l'énergie gagnerait en pertinence s'il s'appuyait mieux sur les données scientifiques qui sous-tendent sa « production » et son emploi, et qui sont trop fréquemment ignorées par les médias ou par les politiciens. Le physicien s'irrite souvent devant des affirmations simplistes en contradiction avec des ordres de grandeur qui devraient être connus de tous. Il est vrai que le concept d'énergie est l'un des plus abstraits et des plus multiformes de la science et qu'il ne date que d'un siècle et demi ; ceci explique sans doute pourquoi l'enseignement n'est pas encore parvenu à rendre familières des notions de physique fondamentale qui sont essentielles à la formation du citoyen, dans un monde où l'énergie est omniprésente.
Comme on le voit en consultant dictionnaires ou encyclopédies, l'énergie ne peut être définie qu'indirectement. Bien qu'elle soit liée aux propriétés de la matière, c'est un objet mathématique abstrait. Nécessaire à une formulation précise du premier principe de la thermodynamique, elle apparaît à l'échelle microscopique comme une grandeur dynamique, ainsi qu'on le verra plus loin (fin de la partie « Energie mécanique »). Il s'agit d'une quantité que l'on peut associer à tout système et qui est fonction des divers paramètres caractérisant l'état de celui-ci à l'instant considéré ; elle dépend en particulier des positions et vitesses des parties du système et de leurs interactions mutuelles. Son caractère essentiel est de rester constante au cours du temps lorsque le système est isolé.
L'assimilation du concept d'énergie suppose une longue familiarisation avec ses divers aspects et avec les phénomènes où il intervient. Bien que l'histoire de son élaboration soit longue et tortueuse, certains épisodes sont éclairants et présentent un intérêt pédagogique. Ils exhibent aussi d'instructives interactions entre sciences et techniques. C'est pourquoi nous en donnons ci-dessous un aperçu ; de nombreux autres aspects biographiques ou anecdotiques intéressants sortent du présent cadre. On consultera avec fruit le monumental Dictionary of scientific biography de C. C. Gillispie (Scribner's, New York, 1981, 16 volumes). Seul l'historique du premier principe est présenté ici avec quelque détail ; pour le deuxième principe, on pourra lire la section 3.4 du livre From microphysics to macrophysics de R. Balian (Ed. Springer Verlag, tome I, 1991 ; édition française en préparation).
Energie mécanique
Même en ce qui concerne la dynamique de processus non dissipatifs comme les mouvements des astres, les oscillations d'un pendule non amorti, les chocs élastiques de solides idéaux ou la dynamique de fluides non visqueux, la notion d'énergie mécanique, grandeur conservative, n'est apparue clairement qu'au milieu du XIXème siècle. De tels processus sont caractérisés par l'évolution des variables décrivant les positions des divers éléments du système. Isaac Newton (1642-1727) trouva entre 1665 et 1667 les équations qui régissent cette évolution ; il les publia en 1687 dans ses Philosophiae naturalis principia mathematica. La conservation au cours du temps de la quantité de mouvement fut reconnue très tôt, par Christiaan Huygens, physicien et astronome (la Haye 1629-1695), mais il fallut plus d'un siècle pour montrer que les équations du mouvement conservaient aussi une autre grandeur, l'énergie.
Un premier pas fut accompli grâce à l'établissement par Lagrange du « théorème des forces vives » : le travail reçu par chaque point matériel (de masse m et de vitesse v) d'un système au cours d'un processus non dissipatif est égal à la moitié de l'accroissement de sa force vive mv2. Afin de passer de là à la conservation de l'énergie mécanique, somme des énergies potentielle et cinétique, il restait à reconnaître que les forces appliquées au système dérivent en général d'un potentiel, puis à identifier leur travail à la diminution d'une certaine fonction des variables de position appelée « énergie potentielle », enfin à baptiser « énergie cinétique » la demi force vive.
Ces étapes furent entravées par l'absence d'un vocabulaire adéquat. Sans doute en raison du rôle central que Newton faisait jouer à la force dans sa formulation des équations de la dynamique, le mot de force fut longtemps employé non seulement dans son sens actuel mais aussi (accompagné éventuellement d'un adjectif tel que « vive ») pour désigner une énergie, ainsi que le mot de puissance. Mayer écrit ainsi en 1842 que « les plantes absorbent une forme de puissance, la lumière, et en produisent une autre, la différence chimique ». Le terme de travail dans son acception scientifique ne fut proposé qu'en 1821 par Coulomb. L'introduction en physique du mot energy date de 1807 ; elle est due à Thomas Young, physiologiste, physicien et linguiste anglais (1773-1829) ayant découvert le mécanisme de l'accommodation par l'œil, les interférences, les lois de l'élasticité, et concurrent passionné de Champollion. Mais ce vocable n'avait encore qu'un sens vague. Encore en 1847, lorsque Helmholtz découvrit (partie « Naissance de la thermodynamique ») la généralité et l'importance de la conservation de l'énergie (sous toutes ses formes), il intitula le livre même où il l'énonçait Űber die Erhaltung der Kraft. C'est en 1850 que William Thomson proposa d'employer « energy » au lieu de « force ». William Rankine, ingénieur et physicien écossais (1820-1872) ayant perfectionné la machine à vapeur, parvint enfin en 1853 à formuler en termes modernes la conservation de l'énergie mécanique (potentielle plus cinétique). Le mot « énergie » n'apparaît cependant pas avant 1875 dans la littérature scientifique française.
Une forme mathématique précise à été donnée à la conservation de l'énergie mécanique grâce aux progrès de la mécanique analytique. Selon cette discipline, marquée par les mathématiciens Louis de Lagrange (Turin 1736 – Paris 1813) et sir William Hamilton (Dublin 1805-1865), les équations de la dynamique non dissipative sont engendrées à partir du hamiltonien, somme de l'énergie cinétique et de l'énergie potentielle considérées comme fonctions des variables de position et de leurs moments conjugués. Pour un système isolé, le hamiltonien ne dépend pas explicitement du temps, et les équations du mouvement admettent une intégrale première égale au hamiltonien lui-même. L'énergie mécanique apparaît donc comme la valeur, qui demeure constante au cours du temps, du hamiltonien. Il pouvait sembler artificiel, au milieu du XIXème siècle, d'avoir mis sur pied une théorie aussi formelle et aussi élaborée pour ne traiter que de systèmes particuliers, non dissipatifs, somme toute exceptionnels. Nous verrons (partie « L'apport de la physique statistique ») que cette même théorie s'est ultérieurement révélée adéquate, de façon inattendue, pour les systèmes les plus généraux, à condition de les décrire en tenant compte de tous leurs degrés de liberté microscopiques.
Premières études sur la chaleur
Il n'a été question dans ce qui précède que de phénomènes purement mécaniques, sans production ni absorption de chaleur. L'étude des phénomènes calorifiques commence par les premières mesures de calorimétrie dues à Pierre Simon de Laplace, astronome, mathématicien et physicien (Beaumont-en-Auge 1749 – Paris 1827), et à Antoine Laurent de Lavoisier (Paris 1743-1794) qui déterminèrent en 1782-84 une série de chaleurs spécifiques et de chaleurs de réaction.
L'étape suivante est marquée par Benjamin Thompson, aventurier et officier américain (1753 – Auteuil 1814) devenu ministre de la guerre en Bavière sous le nom de comte Rumford. Après avoir perfectionné le calorimètre, il mesura entre 1798 et 1804 la quantité de chaleur produite lors du forage de canons et comprit qu'elle devait être proportionnelle au travail fourni.
Inversement, divers inventeurs avaient déjà réussi à extraire empiriquement une « force motrice » à partir de chaleur. Denis Papin, après avoir imaginé sa célèbre « marmite », ancêtre de l'autoclave, fit des tentatives dans ce sens lors de son exil en Allemagne et en Angleterre après la révocation de l'édit de Nantes ; il parvint à construire en 1707 à Kassel le premier bateau à vapeur, qui fut malheureusement détruit par les bateliers lors de ses essais, et il mourut dans la misère (Blois 1647 – Londres 1714). Les mécaniciens anglais Thomas Savery et Thomas Newcomen mirent au point entre 1689 et 1705 les premières machines à feu, utilisables mais dont le rendement n'était que de 1%. James Watt, mécanicien écossais (1736-1819) chargé par l'Université de Glasgow de réparer un modèle réduit de démonstration d'une machine de Newcomen, découvrit que celle-ci pouvait être considérablement perfectionnée. Il breveta en 1769 la première véritable machine à vapeur, et y apporta par la suite de multiples améliorations.
Toutes ces expériences et réalisations s'interprètent aujourd'hui comme des transformations en chaleur d'une énergie mécanique ou chimique, ou inversement. Pourtant, à l'époque, en l'absence du concept d'énergie, on considérait généralement la chaleur comme l'un des quatre « fluides impondérables », appelé calorique, à côté de la lumière, de l'électricité et du magnétisme. Ce calorique pouvait imprégner les corps matériels pesants et se conservait lors des transformations de ceux-ci. Une telle conception du calorique en tant que fluide conservé était encore répandue jusque vers 1840, malgré les expériences de Rumford et malgré la généralisation des machines à vapeur. Afin de progresser, il fallait explorer mieux les propriétés de la chaleur et comprendre sa nature. L'histoire de cette quête, difficile, qui s'étendit tout au long du XIXème siècle, fait l'objet du passionnant ouvrage de S. G. Brush, The kind of motion we call heat (North Holland, 1976, deux volumes). Nous la résumons dans les deux parties qui suivent.
Naissance de la thermodynamique
Au cours de la première moitié du XIXème siècle, les découvertes se sont succédées dans un ordre opposé à celui que nous estimons actuellement logique ou pédagogique. C'est ainsi qu'avec les études de Fourier sur la propagation de la chaleur, la notion de flux d'énergie, qui sous-tend la dynamique des processus irréversibles, est apparue une cinquantaine d'années avant celle d'énergie, pourtant plus simple puisqu'elle concerne l'équilibre. Il est vrai que, pour ce problème, le flux d'énergie pouvait encore s'interpréter comme un flux de calorique. Joseph Fourier (1768-1830), l'un des premiers professeurs à l'Ecole Polytechnique avec Monge et Lagrange, participa à l'expédition d'Egypte, puis devint préfet de l'Isère sous l'Empire tout en consacrant ses loisirs aux mathématiques et à la physique. A travers un impressionnant ensemble de travaux, il résolut le « problème de la chaleur » qui avait été mis au concours par l'Académie des Sciences. Il parvint d'abord à trouver (article « II - Conséquences énergétiques des principes fondamentaux » - partie 3 « Principes de la thermodynamique hors équilibre ») les équations du problème (1811), inventa les séries dites de Fourier (1812) pour tenter de les résoudre, puis les intégrales de Fourier qui lui permirent enfin d'aboutir à une solution complète ; il publia ses résultats quelques années plus tard (1822) sous le titre de Théorie analytique de la chaleur.
De même, la découverte de ce que nous appelons le « deuxième » principe de la thermodynamique précéda d'une vingtaine d'années celle du « premier ». On la doit à Sadi Carnot (Paris 1796-1832) qui, inspiré par l'étude théorique des machines à vapeur, énonça en 1824 sous une forme déjà claire ce principe dans ses Réflexions sur la puissance motrice du feu et les machines propres à développer cette puissance. Cette publication constitue l'acte fondateur de la thermodynamique. Carnot donna en particulier une expression correcte pour le rendement des machines à vapeur, rapport du travail fourni à la chaleur reçue de la source chaude au cours d'un cycle. Mais il n'écrivit pas le bilan global, ne se souciant pas de la chaleur cédée à la source froide. Plus ou moins consciemment, il adhérait encore alors à la théorie du calorique, fluide qui s'écoulerait sans perte de la source chaude vers la source froide, comme l'eau qui met en mouvement une roue de moulin. Cependant, quelques années plus tard, Carnot comprit que le travail produit était soustrait à ce flux de chaleur, et prit ainsi conscience de l'équivalence entre travail et chaleur. Malheureusement, après sa mort lors de l'épidémie de choléra de 1832, la majeure partie de ses meubles et de ses papiers fut détruite par mesure d'hygiène − bien que l'on se soit interrogé plus tard sur la véritable cause de son décès. Ses écrits où il avait pressenti le premier principe ne furent découverts et publiés qu'un demi-siècle plus tard.
L'établissement définitif de l'équivalence entre travail et chaleur, l'énoncé du premier principe et l'introduction de la notion d'énergie ont requis la convergence d'idées issues de domaines divers. En témoigne la variété des préoccupations de la dizaine de savants qui, plus ou moins en parallèle, ont clarifié ces questions entre 1840 et 1850. Julius Robert von Mayer, médecin allemand de la marine (1814-1878), auteur d'expériences quantitatives sur le métabolisme humain, énonça en 1842 le principe d'équivalence ; il comprit aussi en 1845 que l'assimilation chlorophyllienne réalise une transformation d'énergie lumineuse en énergie chimique. L'équivalence du travail et de la chaleur fut établie avec plus de précision par James Prescott Joule, riche brasseur anglais (1815-1889), physicien amateur, grâce à ses célèbres expériences de 1843-1847 où une chute de poids échauffe l'eau d'un calorimètre grâce au frottement dans l'eau d'une roue à ailettes entraînée par un poids.
Le concept d'énergie fut introduit en toute généralité en 1847 par Hermann von Helmholtz, médecin prussien (1821-1892) qui se consacra très tôt à la physique et apporta des contributions majeures à la plupart des branches de celle-ci. C'est lui qui émit l'idée que les transformations de la matière traduisent des changements de nature de l'énergie, et que la valeur totale de celle-ci reste conservée. Un apport de chaleur ou de travail à un système aboutit à un accroissement équivalent de son énergie interne.
Helmoltz avait été précédé par Ludvig Colding, penseur danois (1815-1888) animé par des motivations métaphysiques, qui imaginait déjà en 1843 l'énergie comme l'essence des choses, une entité sous-jacente à la matière. On peut considérer comme héritiers de Colding les énergétistes tels que Wilhelm Ostwald, chimiste allemand (1853-1932) célèbre pour ses travaux sur l'électrolyse et la catalyse, tenants d'une philosophie teintée de mysticisme largement répandue vers la fin du XIXème siècle. Leur conception de l'énergie, substance continue, incréée et indestructible, devait freiner le développement de la théorie cinétique et de l'atomisme, dont les partisans comme Boltzmann estimaient au contraire que la réalité ultime était faite de particules et non d'énergie (partie « L'apport de la physique statistique »).
Parmi ceux qui ont contribué à l'établissement du premier principe, on trouve aussi des ingénieurs ayant participé aux progrès des machines à vapeur, Rankine dont nous avons parlé à la partie « Energie mécanique », Marc Seguin (Annonay 1786-1875) et Gustave Hirn (Colmar 1815-1890). On trouve enfin un chimiste allemand, Justus von Liebig (1803-1873), et un électrochimiste anglais, William R. Grove (1811-1896), inventeur en 1839 de la pile à hydrogène. Ce sont les travaux de ce dernier, ainsi que la découverte en 1841 de l'effet Joule, qui ont permis d'étendre le concept d'énergie, depuis la mécanique et la chaleur, vers les phénomènes chimiques et électriques. Une quarantaine d'années plus tard, Helmholtz devait relier la force électromotrice d'une pile à son énergie libre de réaction.
L'édifice de la thermodynamique des états d'équilibre fut achevé au cours de la seconde moitié du XIXème siècle. Après qu'Emile Clapeyron (Paris 1799-1864) eut précisé et développé les idées de Carnot, en définissant notamment la notion de réversibilité (1843), Rudolf Clausius, physicien allemand (1822-1888), introduisit en 1854 une grandeur nouvelle, qu'il baptisa entropie en 1865 et qui permettait de donner au deuxième principe une forme plus concise quoique plus abstraite. Son concurrent britannique, William Thomson (1824-1907) qui devait devenir lord Kelvin en 1892, avait introduit en 1848 la température absolue. Dans les dernières décennies du siècle, les potentiels thermodynamiques comme l'énergie libre ou l'enthalpie, fonctions apparentées à la fois à l'énergie interne et à l'entropie, furent bâtis et utilisés par Helmholtz, par son élève Max Planck (1858-1947) et par l'américain Josiah Willard Gibbs (New Haven 1839-1903). En fait, la même idée avait déjà été exploitée par François Massieu [ingénieur des mines, économiste, physicien et mathématicien (1832-1896)] afin de déterminer la chaleur spécifique des fluides à partir de leur équation d'état en vue d'application aux machines à vapeur ; mais son travail publié en 1870 fut méconnu en raison de la guerre franco-allemande.
Selon la formulation moderne de la thermodynamique due à
Laszlo Tisza et Herbert Callen (1960), toutes les propriétés d'équilibre
d'un système sont caractérisées par l'expression de son entropie en
fonction de ses variables conservatives, comme l'énergie et le nombre de
particules constitutives de chaque type. Selon l'équation
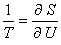 , l'inverse de la température absolue apparaît
alors comme variable conjuguée de l'énergie.
, l'inverse de la température absolue apparaît
alors comme variable conjuguée de l'énergie.
La thermodynamique des processus irréversibles
La thermodynamique des processus dissipatifs hors d'équilibre, initiée par Fourier, avait elle aussi progressé au cours de la première moitié du XIXème siècle. A la loi de Fourier énonçant que le flux de chaleur est proportionnel au gradient de température (gradient qui caractérise l'écart à l'équilibre) avait succédé toute une série de lois empiriques du même type : loi d'Ohm (1827) pour la conduction électrique, lois de Seebeck (1821) et de Peltier (1834) pour les effets thermoélectriques, loi de Fick (1855) pour la diffusion de soluté dans un solvant [Adolf Fick, physiologiste allemand], loi de Darcy (1856) pour l'écoulement à travers un milieu poreux [Henri Darcy, ingénieur au Service des eaux de Dijon]. L'étude de la cinétique chimique s'appuie de même sur la proportionnalité entre le taux de réaction et l'affinité chimique, grandeur caractérisant l'écart à l'équilibre et construite à partir des potentiels chimiques des divers constituants. (Le vocabulaire reste encore aujourd'hui source de confusion ici, puisqu'un potentiel chimique ressemble à une température, et non à un potentiel thermodynamique ou à une énergie potentielle.)
En ce qui concerne la dynamique des fluides, Newton avait déjà introduit une loi définissant la viscosité. Les équations complètes furent écrites en 1825 par Henri Navier, ingénieur des Ponts et Chaussées (Dijon 1785 – Paris 1836), s'appuyant sur des rudiments de théorie cinétique. Cependant, l'atomisme étant au cours des années suivantes rejeté par la plupart des savants au fur et à mesure que se développait la physique du continu, il fallut attendre 1845 pour que la communauté fût convaincue par les arguments de sir George Gabriel Stokes (Irlande 1819 – Cambridge 1903) du bien-fondé des équations dites aujourd'hui de Navier–Stokes.
Tous ces phénomènes d'apparences diverses n'ont pu être englobés dans un cadre cohérent qu'à la suite des travaux effectués en 1931 par De Donder, chimiste belge, et par Lars Onsager (Olso 1903 – Miami 1976), physicien théoricien. Ainsi est née la thermodynamique des processus irréversibles, théorie systématique et unifiée régissant le déroulement dans le temps de ces processus. Malgré son importance, cette discipline n'est encore guère enseignée que de façon fragmentaire (voir cependant R. Balian, op. cit. Tome II, chap. 14). Nous en rappellerons dans l'article « II - Conséquences énergétiques des principes fondamentaux » - partie 3 « Principes de la thermodynamique hors équilibre » les principes fondamentaux, qui ne doivent pas être confondus avec ceux de la thermodynamique usuelle. Celle-ci ne traite en effet que de l'état initial d'un processus et de son état final, tous deux en quasi-équilibre, et non de la manière dont le système passe de l'un à l'autre.
L'apport de la physique statistique
Aussi bien la thermodynamique traditionnelle que celle des processus irréversibles souffrent d'un défaut. Des concepts fondamentaux, chaleur, température, énergie, entropie, y présentent un caractère abstrait difficile à appréhender, même si la théorie permet leur manipulation mathématique en conduisant à des prévisions en accord avec l'expérience. Ce fut un apport majeur d'une nouvelle science, la physique statistique, que de clarifier la signification de ces concepts en leur donnant à l'échelle microscopique une interprétation mécaniste et probabiliste.
En ce qui concerne les gaz, ce progrès fut effectué grâce à la théorie cinétique, principalement élaborée par James Clerk Maxwell (Edimbourg 1831 – Cambridge 1879) et par Ludwig Boltzmann (Vienne 1844 – Trieste 1906). La description d'un gaz en tant qu'assemblée de très nombreuses molécules, n'interagissant que lors de collisions très brèves, permet d'interpréter dans un état macroscopique d'équilibre ou voisin de l'équilibre la densité comme un nombre moyen de molécules par unité de volume, la pression comme une force moyenne exercée sur une paroi sous l'effet des collisions de molécules sur cette paroi, l'entropie comme une mesure du désordre régnant à l'échelle microscopique. L'énergie interne s'identifie à l'énergie cinétique totale des molécules, le travail fourni par un piston à une énergie mécanique communiquée sous l'effet de collisions, un apport de chaleur à la transmission aux molécules d'une énergie cinétique désordonnée. Pour les matériaux plus condensés que les gaz, l'énergie d'interaction à l'échelle microscopique entre particules constitutives n'est plus négligeable comparée à leur énergie cinétique, et l'énergie macroscopique totale s'identifie à l'énergie mécanique microscopique, somme des énergies cinétique et d'interaction des particules.
Le premier principe de la thermodynamique traduit donc la constance au cours du temps de l'énergie microscopique, grandeur qui a une expression simple en fonction des positions et vitesses des particules constituant le matériau. La théorie cinétique a ainsi abouti à une importante simplification et à un retour en arrière surprenant : en passant à l'échelle microscopique, on n'a plus besoin que de concepts de mécanique analytique ; l'énergie totale s'identifie à la valeur, conservée, du hamiltonien microscopique.
Le deuxième principe exprime que l'état d'équilibre final d'un système est à l'échelle microscopique le plus désordonné parmi ceux que le système puisse atteindre, ce désordre étant mesuré par l'entropie, grandeur statistique. La notion de chaleur, que l'on avait mis si longtemps à dégager et qui était indispensable pour exprimer à notre échelle la conservation de l'énergie, s'évanouit à l'échelle microscopique, où la chaleur n'est qu'une partie (désordonnée) de l'énergie mécanique totale.
Cette explication des concepts et principes de la thermodynamique paraît aujourd'hui naturelle, mais il faut souligner qu'elle ne s'est imposée qu'au XXème siècle. Malgré sa notoriété, Boltzmann allait à contre-courant de la science de son temps et dut lutter rudement pour défendre ses idées. En effet, la physique du continu triomphait alors avec la thermodynamique, l'électromagnétisme, l'optique ou la dynamique des fluides. L'atomisme apparaissait comme une hypothèse hasardeuse dénuée de fondement expérimental : les observations décisives de Jean Perrin datent de 1908, et même des chimistes comme Berthelot refusaient de considérer une réaction chimique comme un réarrangement d'atomes en molécules.
Au cours du XXème siècle, le développement de la physique statistique quantique permit de généraliser, d'abord aux propriétés énergétiques du rayonnement électromagnétique (Planck, 1900 ; Einstein, 1904) puis aux solides et à tout système matériel, les idées initiées par la théorie cinétique des gaz. En conséquence, les bases de la thermodynamique, autrefois érigées en principes fondamentaux autonomes, n'apparaissent plus aujourd'hui que comme de simples conséquences à notre échelle des lois, elles-mêmes simples, de la microphysique. En principe, les propriétés macroscopiques des processus dynamiques hors d'équilibre et les lois de comportement des divers matériaux découlent aussi de la physique microscopique. Les constituants élémentaires d'un matériau sont si nombreux qu'ils ne peuvent être étudiés que par des méthodes statistiques ; cependant, ce grand nombre permet d'effectuer à notre échelle des prévisions quasi certaines, ce qui confère à la théorie son caractère déterministe malgré les probabilités sous-jacentes. Il émerge ainsi à notre échelle des propriétés, déterminisme, continuité, irréversibilité, transitions de phase, qui diffèrent qualitativement des comportements microscopiques.
Ces progrès majeurs constituent une réussite conceptuelle spectaculaire du réductionnisme : grâce à l'application de la mécanique quantique, théorie microscopique, à des systèmes comportant un très grand nombre de particules et à l'emploi de méthodes statistiques, le macroscopique, complexe et varié, s'est ramené au microscopique, simple et unifié, donc plus fondamental. Ceci est particulièrement net pour l'énergie, dont les multiples formes que nous percevons ne sont que des reflets d'une même réalité sous-jacente. Cependant, même si nous savons désormais que les sciences macroscopiques découlent de la microphysique, elles ne sont pas pour autant devenues caduques. En effet, en raison de l'émergence de phénomènes a priori inattendus lorsqu'on passe d'une échelle à l'autre, des études de physique à notre échelle restent toujours indispensables : elles seules permettent de découvrir et d'explorer de tels phénomènes, même si ces derniers peuvent a posteriori trouver leur explication dans la physique microscopique. De plus, celle-ci fait intervenir un très grand nombre de degrés de liberté, dont la manipulation est dans la pratique souvent irréalisable. En particulier, pour les applications de la physique à l'énergétique, une approche macroscopique suffit à la plupart des besoins.
L'apport de la mécanique quantique, de la relativité et de la physique des particules
Même si les progrès de la physique au XXème siècle ont porté principalement sur des aspects microscopiques apparemment éloignés de notre expérience quotidienne, ils ont apporté des éclairages nouveaux sur le concept d'énergie, qui s'est ainsi enrichi et précisé. Par ailleurs, la physique nouvelle a, dans le domaine de l'énergétique, donné naissance à des objets technologiques aussi divers et novateurs que les réacteurs nucléaires ou les piles photovoltaïques.
Nous avons rappelé ci-dessus les origines de la mécanique quantique : afin d'expliquer la loi de Planck, qui régit la manière dont l'énergie se distribue selon les fréquences dans un rayonnement comme celui du Soleil, il faut quantifier le rayonnement, c'est-à-dire le représenter comme une assemblée de particules, les photons. En conséquence, l'énergie d'un rayonnement ne peut prendre que des valeurs discrètes, égales à la somme des énergies des photons qui le constituent. Les progrès ultérieurs de la physique quantique ont montré que la quantification de l'énergie est un phénomène général. L'énergie de tout système fini ne varie pas de façon continue ; elle ne peut prendre que certaines valeurs discrètes bien définies. Cette propriété contraste avec notre expérience courante, qui semble indiquer que l'énergie est une grandeur continue. Cependant, à notre échelle, les valeurs permises pour l'énergie d'un système comportant un grand nombre de constituants élémentaires sont certes discrètes, mais si denses que leur caractère discontinu est invisible.
La microphysique a fait aussi découvrir d'autres aspects de l'énergie, associés à l'évolution au cours du temps. A l'échelle microscopique, la dynamique d'un système est engendrée, en mécanique quantique comme en mécanique analytique (partie « Energie mécanique »), par un hamiltonien, fonction des positions et moments des constituants élémentaires égale à la somme de leurs énergies cinétique et d'interaction. (Le potentiel d'interaction, qui figure ainsi directement dans le lagrangien ou le hamiltonien, présente un caractère plus fondamental que les forces, grandeurs qui en découlent.) En termes de particules élémentaires, il n'y a ni dissipation, ni irréversibilité, ni chaleur : ces notions émergent par passage à l'échelle macroscopique. L'avènement de la mécanique quantique n'a guère modifié ces principes, mais nous devons désormais considérer les positions, moments et autres grandeurs dynamiques non plus comme des variables qui commutent mais comme des opérateurs. Tout objet physique, décrit par un opérateur, se comporte comme une variable aléatoire, qui peut présenter des fluctuations autour de sa valeur moyenne. L'énergie s'interprète alors comme valeur moyenne de l'opérateur hamiltonien H. Les fluctuations statistiques relatives de celui-ci sont faibles pour un système macroscopique, de sorte que le caractère probabiliste de l'énergie est masqué à notre échelle.
De plus, à un instant donné, l'état d'un système quantique défini aussi bien que possible est représenté par une fonction d'onde ψ ; l'évolution de celle-ci se décrit mathématiquement par l'équation de Schrödinger (1926) i η ∂Ψ/∂t = H Ψ, où l'opérateur hamiltonien agit sur la fonction d'onde et où h = 2 πη = 6,6 × 10-34J.s est la constante de Planck. Dans le cadre de la dynamique, l'énergie et le temps apparaissent ainsi comme des grandeurs conjuguées (alors que, comme nous l'avons vu à la partie « Naissance de la thermodynamique », c'est l'énergie et l'inverse de la température qui doivent en thermodynamique être considérées comme conjuguées). Cette correspondance entre temps et énergie, issue de l'équation de Schrödinger, fait intervenir la constante de Planck, les variables conjuguées étant en toute rigueur E et t/h. Elle se voit encore plus clairement lorsque l'on considère un état quantique stationnaire, décrit par une fonction d'onde dont seule la phase varie au cours du temps, en oscillant avec une fréquence ν ; le hamiltonien prend alors une valeur bien définie E . Cette énergie E est alors reliée à la fréquence ν (ou à la période de l'onde) par la relation E=hν de Louis de Broglie (1924).
Une autre situation où temps et énergie sont associés est celle des états métastables en physique atomique (atomes optiquement excités) ou en physique des particules (noyaux radioactifs). De tels états, qui ont une certaine durée de vie τ, sont représentés par des fonctions d'onde décroissant au cours du temps selon la loi exponentielle exp[- t / τ]. Leur énergie est mal définie et on montre que sa fluctuation statistique Γ est reliée au temps de vie par la relation Γ = η/2 τ.
La dualité entre énergie et temps, ainsi que la conservation de l'énergie, entrent en fait dans un cadre plus profond et général. Selon un théorème établi par la mathématicienne Emmy Noether (Erlangen 1882 – Bryn Mawr 1935), toute invariance des lois de la nature sous l'effet des transformations d'un certain groupe a pour conséquence la conservation au cours du temps de certaines grandeurs, qui sont les valeurs moyennes des générateurs infinitésimaux de ce groupe. Par exemple, les trois composantes du moment total constituent en mécanique quantique des opérateurs, générateurs des translations ; l'invariance des lois physiques par translation implique la conservation de la quantité du mouvement, valeur moyenne du moment total (partie « Energie mécanique »). De même, l'invariance par rotation entraîne la conservation du moment cinétique. La conservation de l'énergie, elle, traduit l'invariance des lois par changement d'origine du temps. En effet, selon l'équation de Schrödinger, la variation entre les temps t et t + δ t de la fonction d'onde Ψ est Ψ ( t + dt ) - Ψ ( t ) = H Ψ dt / i η de sorte que l'opérateur hamiltonien est, au facteur 1 / i η près, le générateur des translations dans le temps. L'invariance par translation dans le temps, propriété très intuitive, implique la loi de conservation de l'énergie, qui l'est beaucoup moins, comme l'a montré la difficulté de son élaboration.
La description d'un état quantique par une fonction d'onde ne convient que pour des objets microscopiques, qui sont aussi contrôlables que ne le permet le caractère probabiliste imposé par la physique quantique. L'introduction en 1927 par Lev Davidovitch Landau et Johann (John) von Neumann de la notion de mélange statistique, forme que prend la notion d'état quantique pour les systèmes macroscopiques, permit de préciser les idées de Boltzmann sur l'entropie en tant que mesure du désordre ; von Neumann écrivit en effet son expression générale en termes de la description microscopique, probabiliste et quantique, des systèmes. Cette expression devait inspirer les ingénieurs et mathématiciens Claude Shannon et Warren Weaver en 1948, lorsqu'ils créèrent la théorie de la communication basée sur la mesure des quantités d'information. En retour, Léon Brillouin fut conduit en 1950 à établir l'équivalence entre l'entropie et la mesure du manque d'information microscopique sur les systèmes que considère la thermodynamique (voir R. Balian, Entropie, information : un concept protéiforme, Université de tous les savoirs, vol. 4, pp. 947-959, Odile Jacob 2001).
L'existence de fluctuations quantiques a permis de prévoir certains phénomènes exotiques, qui ont pu être observés. Ainsi, l'effet Casimir (1948) est associé à un concept nouveau, celui d'énergie du vide. Dans une région vide de l'espace délimitée par des parois non chargées, le champ électromagnétique est nul, mais seulement en moyenne ; il présente des fluctuations autour de zéro. Etant donné qu'un champ possède une énergie qui est proportionnelle à son carré, ses fluctuations se traduisent par une valeur non nulle pour cette énergie, même dans une région vide. Cette valeur dépend de la position et de la forme des parois. En conséquence, les parois se trouvent soumises à des forces exercées par le vide, que l'on a pu mesurer.
La relativité a, comme la physique quantique, apporté plusieurs changements de perspective sur le concept d'énergie. La relativité restreinte (1905) obligea à considérer, pour une particule ponctuelle, les coordonnées de position et le temps comme des variables pouvant se combiner entre elles lorsqu'on change de repère ; elles forment les quatre composantes d'une seule entité, un quadrivecteur. De même, l'énergie se combine aux trois coordonnées du vecteur quantité de mouvement (ou moment) pour former un quadrivecteur, de sorte qu'énergie et moment sont des grandeurs de nature similaire. La dualité entre temps et énergie apparaît ainsi sous un jour nouveau, en parallèle avec la dualité entre position et moment. De plus, la relativité fixe la constante additive arbitraire qui pouvait être incluse dans la définition pré-relativiste de l'énergie.
Par ailleurs, la célèbre formule E=mc² d'Einstein mit en évidence une équivalence entre masse et énergie. Avec la relativité générale, la densité d'énergie prit un aspect géométrique puisque cette grandeur s'interpréta comme l'une des composantes d'un tenseur, relié par les équations d'Einstein à la courbure de l'espace-temps. Enfin, dans ce même cadre, l'énergie du vide, définie sans constante additive, a des conséquences cosmologiques puisqu'elle implique que le vide se comporte comme s'il avait une masse.
La science du XXème siècle a aussi été marquée par l'apparition de la physique des particules, molécules et atomes, puis électrons et noyaux, puis encore constituants de ces derniers à des échelles de plus en plus petites. Elle a eu pour origine la découverte de la radioactivité (Henri Becquerel, 1896 ; Pierre et Marie Curie, 1898), dont l'étude provoqua pendant quelques années une crise. Ayant observé qu'une masse très faible de radium dégageait un flux d'énergie considérable, transporté par le rayonnement émis et recueilli sous forme de chaleur, Marie Curie s'interrogea avec d'autres sur l'origine de cette énergie. Elle se demanda même si le phénomène de radioactivité ne violait pas la conservation de l'énergie, qui était déjà érigée en dogme. Ces doutes étaient légitimes car les énergies en jeu étaient incomparablement supérieures à celles que l'on connaissait jusque là, et leur production semblait ne pas décroître au cours du temps. Le problème fut résolu par Rutherford et Soddy avec la découverte des mécanismes de la radioactivité et celle des temps de vie, en relation avec des mesures calorimétriques.
L'observation de trois types de rayonnement, α, β et γ, puis l'analyse des rayons cosmiques et surtout le développement des accélérateurs ont progressivement conduit à l'élaboration de la théorie des particules élémentaires et de leurs interactions. Au cours du dernier demi-siècle, cette étude de la matière à des échelles infra-nucléaires a permis de distinguer quatre interactions élémentaires. Cette classification microscopique se reflète à notre échelle par des propriétés fort différentes. Elle présente une importance capitale pour la compréhension des problèmes énergétiques. Nous y reviendrons dans l'article « II - Conséquences énergétiques des principes fondamentaux » - partie 4 « Hiérarchie des énergies ».
Article suivant : « II - Conséquences énergétiques des principes fondamentaux »
Dossier : « Les multiples visages de l'énergie »
Pour citer cet article :
L'élaboration du concept d'énergie, Roger Balian, janvier 2009. CultureSciences Physique - ISSN 2554-876X, https://culturesciencesphysique.ens-lyon.fr/ressource/Elaboration-concept-energie-Balian.xml





